Troubles de la reméthylation
Les déficits liés aux troubles de la reméthylation résident dans les carences en vitamines B méthylées, méthyl vitamine B12 (méthylcobalamine) et 5-méthyltétrahydrofolate (5-MTHF), forme active du folate ou vitamine B9.
L’enzyme méthylènetétrahydrofolate réductase fabriquée par le gène MTHFR est importante pour une réaction chimique impliquant des formes de vitamine B folate (également appelée acide folique ou vitamine B9). Spécifiquement, cette enzyme convertit le 5,10-méthylènetétrahydrofolate (5,10-MTHF) en 5-méthyltétrahydrofolate (5-MTHF). En cas de mutation dans le gène MTHFR, cela va affecter la quantité de folate actif (5-MTHF) disponible.
La méthylation (respectivement la reméthylation) est l'addition d’un groupe méthyle (composé d'un atome de carbone et de 3 atomes d'hydrogène : CH3) à une autre molécule.
Le métabolisme de la méthionine génère différents produits intermédiaires, dont l’un est l’homocystéine. L’homocystéine est ensuite soit dégradée en une substance inoffensive appelée cystathionine, soit à nouveau recyclée en méthionine.
Le principal problème commun à l’ensemble des troubles de la reméthylation est l’interruption de la boucle dans laquelle la méthionine des aliments est transformée en homocystéine, puis l’homocystéine recyclée en méthionine. Cette voie dite de l’homocystéine-méthionine produit des substances majeures (groupes méthyle) qui sont nécessaires dans de nombreuses autres voies métaboliques de l’organisme. Si la voie de l’homocystéine-méthionine est interrompue, ces groupes méthyle ne peuvent être fournis en quantité suffisante.La méthionine est nécessaire pour l'utilisation des groupes méthyle du cycle du folate. La reméthylation de l'homocystéine en méthionine nécessite le 5-méthyltétrahydrofolate (5-MTHF) donneur de carbone, formé par l'action de l'enzyme méthylènetétrahydrofolate réductase (MTHFR).
Dans les troubles de la reméthylation, le problème commun réside dans le fait que l’homocystéine ne peut pas être correctement recyclée en méthionine. C’est la raison pour laquelle l’homocystéine reste élevée et la méthionine est basse dans le sang. La présence d’un niveau élevé de cet acide aminé est uniquement un indicateur de troubles de la conversion des groupes méthyles.
Pour que toutes les fonctions ci-dessus se produisent, le corps doit convertir le folate alimentaire en 5-MTHF (5-méthyltétrahydrofolate) actif à l'aide de cofacteurs. Cette réaction est nécessaire pour le processus en plusieurs étapes qui convertit l'homocystéine en un autre acide aminé, la méthionine.
Le gène MTR fournit des instructions pour la fabrication d'une enzyme appelée méthionine synthase. Cette enzyme convertit l'homocystéine en méthionine, fournissant l'intégralité de la méthionine qui permet à la méthylation de l'ADN de se produire.
Pour fonctionner correctement, la méthionine synthase (MTR) nécessite de la méthylcobalamine (une forme de vitamine B12) et une autre enzyme appelée méthionine synthase réductase, qui est produite à partir du gène MTRR.
Le processus est donc le suivant : la sérine réagit avec le tétrahydrofolate (THF) pour former le 5,10-méthylènetétrahydrofolate (5,10-MTHF), dérivé du folate impliqué dans la synthèse de l'ADN. Chez une personne ne présentant pas de mutation MTHFR, l'enzyme MTHFR convertit ensuite le 5,10-méthylènetétrahydrofolate (5,10-MTHF) en 5-méthyltétrahydrofolate (5-MTHF), qui donne son groupe méthyle à la cobalamine (vitamine B12), formant ainsi la méthylcobalamine, processus qui est perturbé chez une personne présentant une mutation MTHFR. L’enzyme méthionine synthase catalyse alors le don du groupe méthyle de la méthylcobalamine à l’homocystéine, un métabolite des acides aminés, en la convertissant en l’acide aminé méthionine.
Le 5-MTHF est, par conséquent, nécessaire au métabolisme optimal de l'homocystéine, car il agit en tant que donneur de méthyle, fournissant un groupe méthyle à la vitamine B12. La forme méthylée de la vitamine B12 (méthylcobalamine) ainsi obtenue transfère ensuite ce groupe méthyle à l'homocystéine. Le résultat est un recyclage de l'homocystéine en méthionine, entraînant une réduction de l'homocystéine plasmatique.
Nous devons utiliser les groupes méthyle de la méthionine que nous créons et que nous complétons. La méthionine est ensuite convertie en S-adénosylméthionine (SAMe), un donneur de méthyle impliqué dans de nombreux processus biochimiques.
Certains craignent que la supplémentation avec de fortes doses d'acide folique puisse masquer une carence en vitamine B12, entraînant des lésions neurologiques consécutives à une anémie pernicieuse non diagnostiquée. Comme le 5-MTHF ne peut être converti en 5,10-méthylène tétrahydrofolate (impliqué dans la synthèse de l'ADN) après avoir participé au recyclage de l'homocystéine avec la vitamine B12, il ne masquera pas un déficit en B12, car le 5-MTHF n'est pas actif dans la synthèse de l'ADN sans l'aide de B12.
La reméthylation dépend du métabolisme de deux vitamines qui sont essentielles à l’organisme (les folates et la vitamine B12). La 5,10-MTHF (5,10-méthylène tétrahydrofolate) a un rôle majeur dans le métabolisme des folates et la cobalamine est l’autre nom de la vitamine B12. Les déficits liés aux troubles de la reméthylation résident dans les carences en vitamines B méthylées, méthyl vitamine B12 (méthylcobalamine) et 5-méthyltétrahydrofolate (5-MTHF), forme active du folate ou vitamine B9.
Fonction normale du gène MTHFR. Mutations génétiques[1]
Le gène MTHFR joue un rôle centrale dans le métabolisme du folate[2]
Comme nous l’avons vu, le gène MTHFR fournit des instructions pour la fabrication d'une enzyme appelée méthylènetétrahydrofolate réductase. Cette enzyme joue un rôle dans le traitement des acides aminés, les éléments constitutifs des protéines. La méthylènetétrahydrofolate réductase est importante pour une réaction chimique impliquant des formes de vitamine B folate (également appelée acide folique ou vitamine B9). Spécifiquement, cette enzyme convertit le 5,10-méthylènetétrahydrofolate (5,10-MTHF) en 5-méthyltétrahydrofolate (5-MTHF). L'enzyme MTHFR affecte ceci à la dernière étape. Donc, si vous avez une mutation dans le gène MTHFR, cela va affecter la quantité de folate actif (5-MTHF) dont vous disposez.
Comparaison de l'acide folique et du 5-méthyltétrahydrofolate[3]
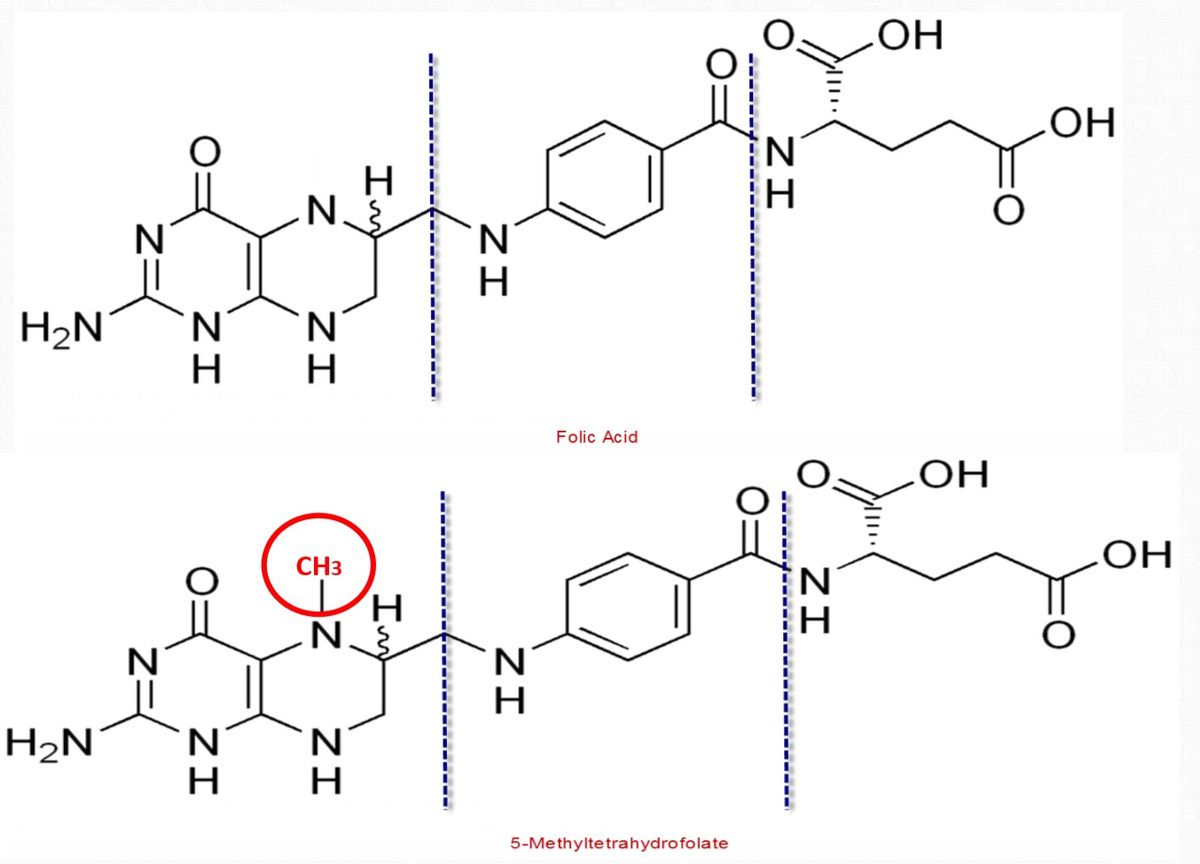
Regard sur les enzymes nécessaires à la conversion de l'acide folique en méthylfolate
Deux enzymes sont fonctionnelles :
- MTHFD1
- MTHFR

L’enzyme MTHFR est à la dernière étape et l’étape finale de la conversion de l’acide folique en méthylfolate.
Qu'est-ce que la méthylation (et la reméthylation)?
Des groupes méthyle (composés d'un atome de carbone et de 3 atomes d'hydrogène : CH3) sont nécessaires pour une vaste gamme de fonctions dans le corps. La méthylation est l'addition de ce groupe méthyle (en une seule fois) à une autre molécule. La méthylation est le processus par lequel votre corps transfère un ensemble d'atomes dans une série d'acides aminés, de protéines, d'enzymes et d'ADN dans chaque cellule et tissu de votre corps.
Si vous êtes à court de groupes méthyliques, votre corps ne peut pas répondre à tous les nutriments, vitamines, minéraux ou végétaux que vous ingérez dans votre corps. La maladie chronique n'est donc pas loin.
Troubles de la reméthylation
Le métabolisme de la méthionine est complexe, dépendant de nombreuses étapes, et génère différents produits intermédiaires, dont l’un est l’homocystéine. L’homocystéine est ensuite soit dégradée en une substance inoffensive appelée cystathionine, soit à nouveau recyclée en méthionine. Différentes enzymes sont requises pour le déroulement de ce processus. Certaines enzymes ont besoin d‘une vitamine (ou « cofacteur »).[4]
Le principal problème commun à l’ensemble des troubles de la reméthylation est l’interruption de la boucle dans laquelle la méthionine des aliments est transformée en homocystéine, puis l’homocystéine recyclée en méthionine. Cette voie dite de l’homocystéine-méthionine produit des substances majeures (groupes méthyle) qui sont nécessaires dans de nombreuses autres voies métaboliques de l’organisme. Si la voie de l’homocystéine-méthionine est interrompue, ces groupes méthyle ne peuvent être fournis en quantité suffisante. En conséquence, d’autres fonctions majeures de l‘organisme sont perturbées.
La méthionine est nécessaire pour l'utilisation des groupes méthyle du cycle du folate. La reméthylation de l'homocystéine en méthionine nécessite le 5-méthyltétrahydrofolate (5-MTHF) donneur de carbone, formé par l'action de l'enzyme méthylènetétrahydrofolate réductase (MTHFR). Les déficiences héréditaires en MTHFR sont donc une cause fréquente d'hyperhomocystéinémie.[5]

Dans les troubles de la reméthylation, le problème commun réside dans le fait que l’homocystéine ne peut pas être correctement recyclée en méthionine. C’est la raison pour laquelle l’homocystéine reste élevée et la méthionine est basse dans le sang. La présence d’un niveau élevé de cet acide aminé est uniquement un indicateur de troubles de la conversion des groupes méthyles. En outre, le taux élevé d’homocystéine en lui-même peut provoquer des problèmes de santé.
Certains des troubles de la reméthylation entraînent un autre problème : ils altèrent l‘élimination de l’acide méthylmalonique (AMM) des cellules du corps. Dans ces maladies, l’AMM est également élevé dans le sang et l’urine, et peut provoquer d‘autres problèmes médicaux.
Pour que toutes les fonctions ci-dessus se produisent, le corps doit convertir le folate alimentaire en 5-MTHF (5-méthyltétrahydrofolate) actif à l'aide de cofacteurs. Cette réaction est nécessaire pour le processus en plusieurs étapes qui convertit l'homocystéine en un autre acide aminé, la méthionine.
L'équilibre B12 en référence aux gènes MTR et MTRR[6]
Le gène MTR fournit des instructions pour la fabrication d'une enzyme appelée méthionine synthase. Cette enzyme convertit l'homocystéine en méthionine, empêchant l'accumulation négative d'homocystéine dans le sang et fournissant l'intégralité de la méthionine qui permet à la méthylation de l'ADN de se produire :
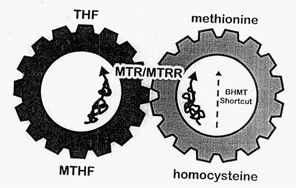
Le corps utilise ensuite la méthionine pour fabriquer des protéines et d'autres composés importants, et est nécessaire pour l'utilisation des groupes méthyle du cycle du folate.
Pour fonctionner correctement, la méthionine synthase (MTR) nécessite de la méthylcobalamine (une forme de vitamine B12) et une autre enzyme appelée méthionine synthase réductase, qui est produite à partir du gène MTRR.
Sans méthionine synthase réductase (MTRR), la méthionine synthase (MTR) ne peut pas convertir l'homocystéine en méthionine.
Intérêt de la méthylcobalamine (vitamine B12)[7]
Chez une personne ne présentant pas de mutation MTHFR, la sérine réagit avec le tétrahydrofolate (THF) pour former le 5,10-méthylènetétrahydrofolate (5,10-MTHF), dérivé du folate impliqué dans la synthèse de l'ADN. L'enzyme MTHFR convertit ensuite le 5,10-méthylènetétrahydrofolate (5,10-MTHF) en 5-méthyltétrahydrofolate (5-MTHF), qui donne son groupe méthyle à la cobalamine (vitamine B12), formant ainsi la méthylcobalamine, processus qui est perturbé chez une personne présentant une mutation MTHFR. L’enzyme méthionine synthase catalyse alors le don du groupe méthyle de la méthylcobalamine à l’homocystéine, un métabolite des acides aminés, en la convertissant en l’acide aminé méthionine.
Le 5-MTHF est, par conséquent, nécessaire au métabolisme optimal de l'homocystéine, car il agit en tant que donneur de méthyle, fournissant un groupe méthyle à la vitamine B12. La forme méthylée de la vitamine B12 (méthylcobalamine) ainsi obtenue transfère ensuite ce groupe méthyle à l'homocystéine. Le résultat est un recyclage de l'homocystéine en méthionine, entraînant une réduction de l'homocystéine plasmatique.
Nous devons utiliser les groupes méthyle de la méthionine que nous créons et que nous complétons. La méthionine est ensuite convertie en S-adénosylméthionine (SAMe), un donneur de méthyle impliqué dans de nombreux processus biochimiques.
Certains craignent que la supplémentation avec de fortes doses d'acide folique puisse masquer une carence en vitamine B12, entraînant des lésions neurologiques consécutives à une anémie pernicieuse non diagnostiquée. Comme le 5-MTHF ne peut être converti en 5,10-méthylène tétrahydrofolate (impliqué dans la synthèse de l'ADN) après avoir participé au recyclage de l'homocystéine avec la vitamine B12, il ne masquera pas un déficit en B12, car le 5-MTHF n'est pas actif dans la synthèse de l'ADN sans l'aide de B12.

Figure 1.a : Métabolisme du folate
Ces processus essentiels à notre survie engagent également d’autres éléments chimiques dont principalement : la choline, la bétaïne, la vitamine B6, la vitamine B12 (Méthylcobalamine), la vitamine B9 (et ses dérivés dont les Tétrahydrofolates) et la S-Adénosylméthionine (SAM). Ces molécules ont toutes une relation plus ou moins directe avec le processus de conversion de l’homocystéine et les causes des différentes pathologies associées.

Figure 1.b : Métabolisme du MTHFR : cycle folate, cycle méthionine, transsulfuration et hyperhomocystéinémie
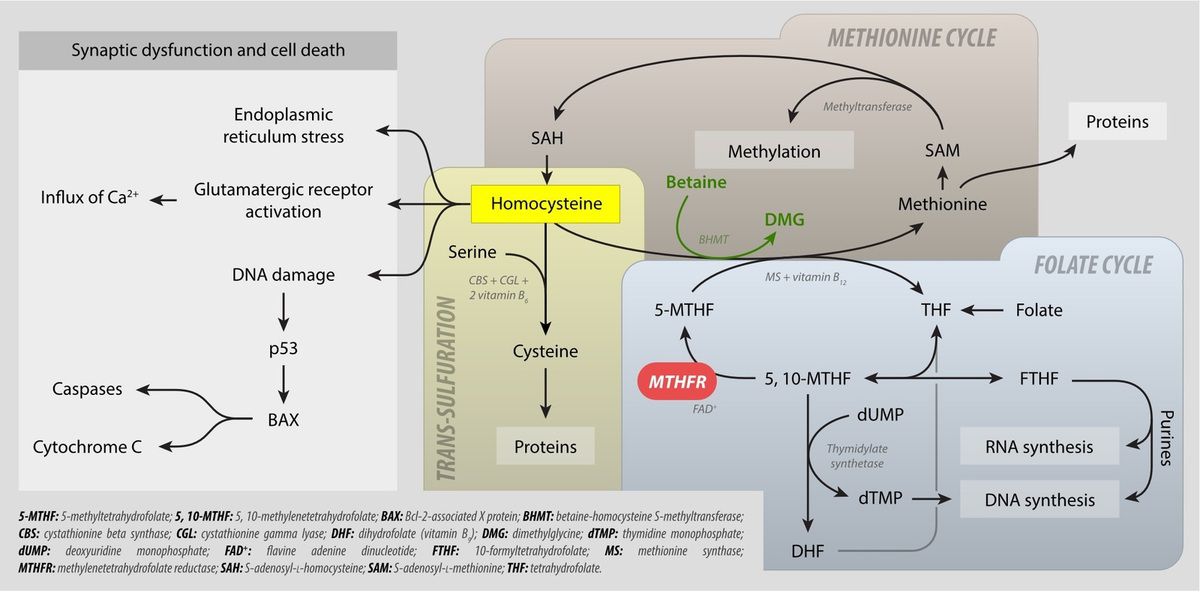
5-MTHF: 5-méthyltétrahydrofolate ;
5,10-MTHF : 5,10-méthyltétrahydrofolate ;
BAX: protéine X associée à Bcl-2 ;
BHMT: bétaïne-homocystéine S-méthyltransférase ;
CBS: cystathionine bêta synthase ;
CGL: cystathionine gamma-lyase ;
DHF: dihydrofolate (vitamine B9) ;
DMG: diméthylglycine ;
dTMP: thymidine monophosphate ;
dUMP: désoxyuridine monophosphate ;
FAD : flavine adénine dinucléotide ;
FTHF: 10-formyltétrahydrofolate ;
MS: méthionine synthase ;
MTHFR: méhtylènetétrahydrofolate réductase ;
SAH: S-adénosyl-L-homocystéine ;
SAM (SAMe): S-adénosyl-L-méthionine ;
THF: tétrahydrofolate.
Les déficits liés aux troubles de la reméthylation
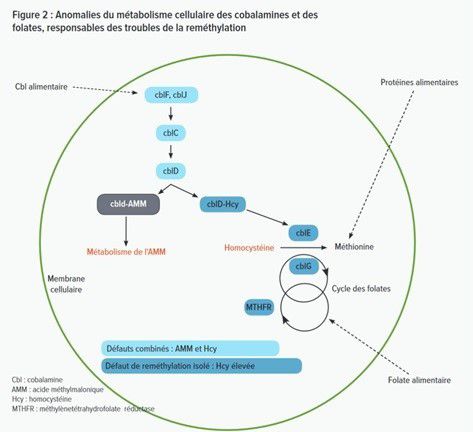
Plusieurs affections appartiennent à ce groupe ; leurs noms sont cités ci-après :
Défaut cobalamine C (cblC)
Défaut cobalamine D (cblD)
Défaut cobalamine E (cblE)
Défaut cobalamine F (cblF)
Défaut cobalamine G (cblG)
Défaut cobalamine J (cblJ)
Déficit sévère en 5,10-méthylène tétrahydrofolate réductase (5,10-MTHFR)
Les défauts cblC, cblF et cblJ affectent tant la voie de l’homocystéine–méthionine que celle d'une substance appelée acide méthylmalonique (AMM) issue de la méthionine et d‘autres acides aminés essentiels comme l‘isoleucine, la valine et la thréonine.
Les personnes atteintes d’un défaut cblD peuvent présenter soit ces déficits combinés, soit des problèmes isolés des voies de l’homocystéine-méthionine ou de l’AMM. Le variant présenté par la maladie dépend de la localisation des mutations sur le gène responsable du défaut cblD.
Le déficit sévère en MTHFR, ainsi que les défauts cblE et cblG, perturbent uniquement la voie homocystéine–méthionine ; ainsi, l’AMM est normal chez les personnes atteintes.
[1] https://ghr.nlm.nih.gov/gene/MTHFR#conditions et MTHFRsupport Australia.
[2] https://www.ohsu.edu/xd/health/services/cancer/getting-treatment/services/knight-diagnostic-laboratories/upload/MTHFR-Mutation-pdf.pdf
[5] https://www.ohsu.edu/xd/health/services/cancer/getting-treatment/services/knight-diagnostic-laboratories/upload/MTHFR-Mutation-pdf.pdf
[6] MTHFRsupport Australia.
[7] 5-Methyltetrahydrofolate, Alternative Medicine Review, Volume 11, Number 4, 2006.

/image%2F2517154%2F20190326%2Fob_e5cdc3_adn-image.jpg)