Mutation MTHFR
Ce test génétique peut révéler une perte partielle de fonction de l'enzyme fabriquée par les gènes MTHFR qui se trouvent sur les deux chromosomes 1 de la paire. Un gène MTHFR fournit, en effet, des instructions pour la fabrication d'une enzyme appelée méthylènetétrahydrofolate réductase.
Il y a actuellement un total de 34 mutations connues dans le gène MTHFR. Les mutations génétiques sont héréditaires.
Il y a deux variantes clés qui sont testées (car à ce stade, il y a peu ou pas de recherche sur les autres). Les deux principaux gènes impliqués dans ce processus sont MTHFR C677T et A1298C [où C677T (rs1801133) et A1298C (rs1801131) sont des polymorphismes à un seul nucléotide (SNP)].
Un bébé porteur d’une copie d’un gène muté sur un seul chromosome de la paire, hérité d’un seul parent, la copie du gène sur l’autre chromosome de la paire étant normale est dit hétérozygote.
Un nouveau-né qui a hérité des copies des deux gènes mutés, un de chaque parent, sur les deux chromosomes de la paire est dit homozygote, si les gènes mutés sont les mêmes.
Un nouveau-né qui a hérité des copies des deux gènes mutés, un de chaque parent, sur les deux chromosomes de la paire est dit composé homozygote, si les gènes mutés sont différents.
Les polymorphismes à un seul nucléotide (SNP) C677T et A1298C régulent négativement l’activité de l'enzyme fabriquée par les gènes MTHFR.
Le nucléotide MTHFR en position 677 dans le gène a deux possibilités : C (cytosine) ou T (thymine). C en position 677 est l'allèle normal. L'allèle 677T encode une enzyme thermolabile à activité réduite.
Les individus avec deux copies de 677C (677CC) ont le génotype le plus commun. Les individus 677TT (homozygotes) ont une activité MTHFR inférieure à celle des individus CC ou CT (hétérozygotes). Les individus de 677TT sont prédisposés à une hyperhomocystéinémie modérée (taux élevés d'homocystéine dans le sang), car ils ont moins de MTHFR actif pour produire du 5-méthyltétrahydrofolate (utilisé pour diminuer l'homocystéine). De faibles apports alimentaires en acide folique peuvent également provoquer une hyperhomocystéinémie légère.
Une faible consommation de folate affecte davantage les individus du génotype 677TT. 677TT chez les patients ayant des taux plasmatiques de folate plus faibles sont à risque de présenter des taux plasmatiques d'homocystéine plus élevés. La protéine encodée par le 677T perd son cofacteur FAD trois fois plus vite que la protéine de type primitif. Le 5-méthyl-THF ralentit le taux de libération de FAD dans les enzymes tant primitives que mutantes, bien que ce soit beaucoup plus dans l'enzyme mutante. Le faible taux en folate avec la perte de FAD qui en résulte améliore la thermolabilité de l'enzyme, fournissant ainsi une explication aux niveaux normalisés d'homocystéine et de méthylation de l'ADN chez les individus 677TT ayant suffisamment de folate.
Ce polymorphisme et une hyperhomocystéinémie modérée sont associés à des anomalies du tube neural chez la progéniture, à un risque accru de complications de la grossesse, d’autres complications de la grossesse, de thromboses artérielles et veineuses et de maladies cardiovasculaires. Les sujets 677TT courent un risque accru de leucémie aiguë lymphoblastique et de cancer du côlon.
Les mutations du gène MTHFR pourraient être l'un des facteurs d'augmentation du risque de développer la schizophrénie. Les patients schizophrènes ayant l'allèle de risque (T\T) présentent davantage de carences dans les tâches de la fonction exécutive.
Le génotype C677T était associé à un risque accru de perte de grossesse récurrente, mais ce lien a été réfuté au cours des dernières années.
Une étude a révélé des corrélations entre la mutation MTHFR 677CT, un polymorphisme de l'Apo E et certains types de démence sénile. D'autres recherches ont montré que les personnes présentant des mutations liées au folate peuvent toujours présenter un déficit fonctionnel même lorsque les taux sanguins de folate sont dans les valeurs normales, et recommande de prendre un supplément de méthyltétrahydrofolate pour prévenir et traiter potentiellement la démence (et la dépression). Une étude a également révélé que C677T SNP était associé à la maladie d’Alzheimer.
Le polymorphisme C677T est associé à un risque d'infarctus du myocarde.
Au nucléotide 1298 du MTHFR, il existe deux possibilités : A ou C. 1298A est le plus courant, tandis que 1298C est moins commun. 1298AA est l'homozygote "normal", 1298AC l'hétérozygote et 1298CC l'homozygote pour la "variante". La protéine codée par 1298C ne peut pas être distinguée de 1298A en termes d'activité, de thermolabilité, de libération de FAD ou de l'effet protecteur du 5-méthyl-THF. La mutation C ne semble pas affecter la protéine MTHFR. Il ne résulte pas de MTHFR thermolabile et ne semble pas affecter les niveaux d'homocystéine.
Un polymorphisme maternel MTHFR A1298C est associé à un risque de grossesse avec le syndrome de Down.
MTHFR A1298C peut jouer un rôle moteur dans le développement du trouble dépressif majeur ou servir de marqueur prédictif ou diagnostique, éventuellement en association avec C677T.
Le déficit sévère en MTHFR est rare (environ 50 cas dans le monde) et est dû à des mutations entraînant une activité enzymatique résiduelle de 0 à 20%.
En épigénétique, l'hyperméthylation du promoteur aberrant MTHFR est associée à la stérilité masculine. En outre, ce phénomène épigénétique inadéquat a été observé dans des échantillons de sperme d'hommes infertiles appartenant à des couples ayant des antécédents d'avortement spontané récurrent. L'hyperméthylation inappropriée du promoteur de MTHFR peut affecter les deux rôles essentiels de la méthylation de l'ADN dans les cellules spermatogénétiques, le processus de méthylation du génome global et l'empreinte génomique des gènes paternels.
La forme active du folate, le L-méthylfolate, peut être appropriée pour cibler les affections affectées par les polymorphismes du MTHFR.
Génétique
Ce test peut révéler une perte partielle de fonction de l'enzyme fabriquée par les gènes MTHFR qui se trouvent sur les deux chromosomes 1 de la paire[1]. Un gène MTHFR fournit, en effet, des instructions pour la fabrication d'une enzyme appelée méthylènetétrahydrofolate réductase.
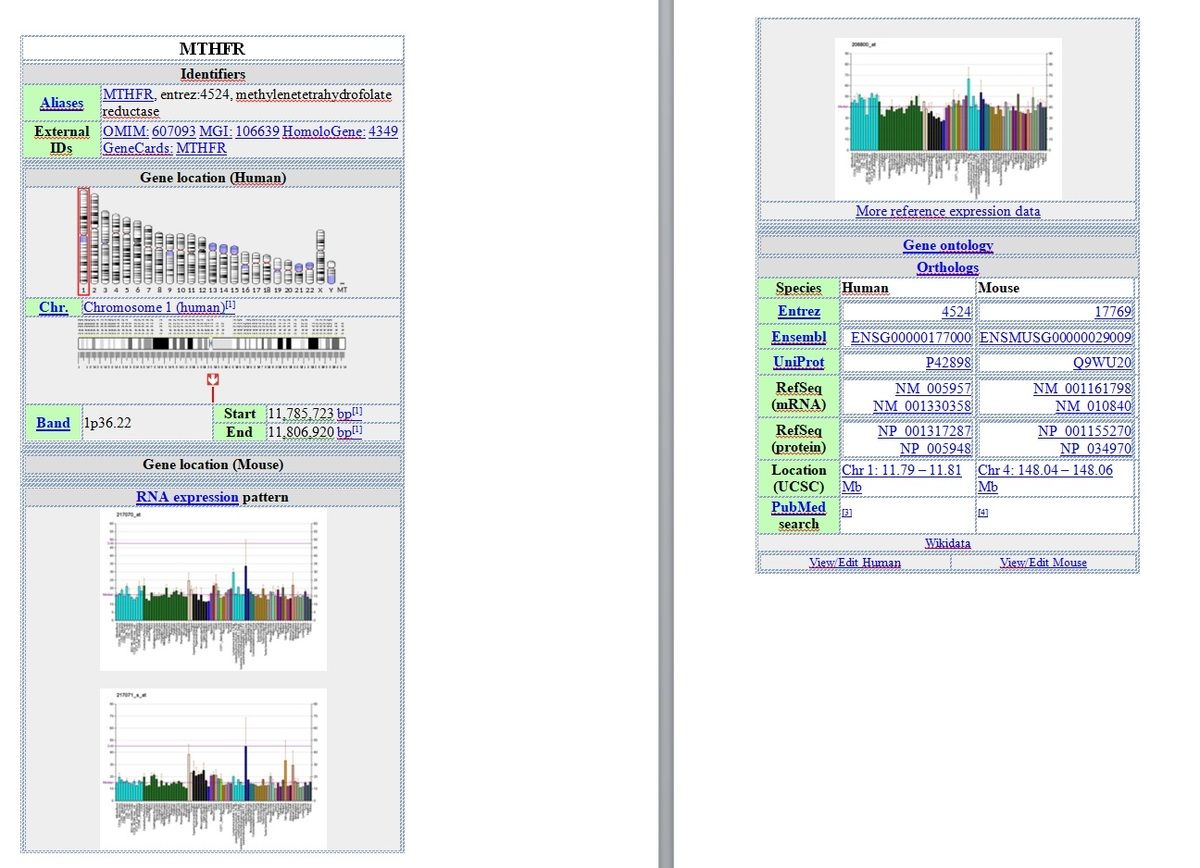
Localisation cytogénétique du gène MTHFR : 1p36.22, qui est le bras court (p) du chromosome 1 à la position 36.22.
Localisation moléculaire : paires de bases 11,785,730 à 11,806,103 sur le chromosome 1 (homo sapiens Annotation Release 109, GRCh38.p12) (NCBI)

Qu'est-ce que MTHFR?
Cet acronyme signifie Méthylène-TétraHydroFolate Réductase. MTHFR est l'acronyme (abréviation) de méthylène-tétrahydrofolate réductase.
Autres noms de ce gène[2] :
5,10-méthylènetétrahydrofolate réductase
5,10-méthylènetétrahydrofolate réductase (NADPH)
méthylènetétrahydrofolate réductase (NAD(P)H)
MTHR_HUMAN
La variation naturelle de ce gène est fréquente.
Les mutations du gène MTHFR[3]
Il y a actuellement un total de 34 mutations connues dans le gène MTHFR. Quelques 45% à 50% de la population générale ont des mutations sur l'un des gènes MTHFR.
Il y a deux variantes clés qui sont testées (car à ce stade, il y a peu ou pas de recherche sur les autres). Les deux principaux gènes impliqués dans ce processus sont MTHFR C677T et A1298C.
Les mutations génétiques sont héréditaires.
Les personnes ayant un gène MTHFR normal sur un chromosome de la paire et le même gène muté ou « des gènes MTHFR de la paire de chromosomes 1 avec la même mutation responsables d’une perte partielle de fonction de l’enzyme fabriquée par ces gènes » sur l’autre chromosome de la paire sont dites « porteuses du même gène muté ». Lorsque les deux parents sont porteurs, il y a 1 risque sur 4 (25%) à chaque grossesse que le nouveau-né ait hérité des deux gènes mutés des deux parents sur les deux chromosomes de la paire. Il y a également 1 risque sur 2 (50%) que le bébé soit porteur d’un seul gène muté sur un seul chromosome de la paire, hérité d’un seul parent, le gène sur l'autre chromosome de la paire étant normal, et 1 chance sur 4 (25%) qu‘il hérite des deux gènes normaux des parents sur les deux chromosomes de la paire.
Le schéma ci-dessous illustre ce fonctionnement :
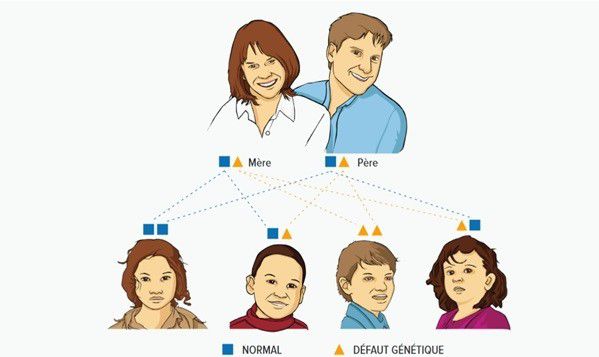
À la conception, on ne peut pas prédire quel ovule et quel spermatozoïde se rencontreront pour former le bébé. Chaque ovule et chaque spermatozoïde renferment la moitié de l’ensemble des gènes du bébé, c‘est-à-dire que chaque ovule porte une copie d’un gène et chaque spermatozoïde porte de même une copie d‘un gène. Le fait que la copie du gène soit défectueuse ou normale est le fruit du hasard. Si l’ovule ou le spermatozoïde ont l’un ou l’autre une copie défectueuse ou s’ils ont tous deux des copies défectueuses, le bébé n’aura qu’un gène normal et un gène muté ou deux gènes mutés.
Les personnes ayant un gène MTHFR normal sur un chromosome de la paire et un gène muté différent ou « des gènes MTHFR de la paire de chromosomes 1 avec des mutations différentes responsables d’une perte partielle de fonction de l’enzyme fabriquée par ces gènes », sur l’autre chromosome de la paire sont dites « porteuses d’un gène muté différent ». Lorsque les deux parents sont porteurs, il y a 1 risque sur 4 (25%) à chaque grossesse que le nouveau-né ait hérité des deux gènes mutés différents des deux parents sur les deux chromosomes de la paire. Il y a également 1 risque sur 2 (50%) que le bébé soit porteur d’un seul gène muté sur un seul chromosome de la paire, hérité d’un seul parent, le gène sur l'autre chromosome de la paire étant normal, et 1 chance sur 4 (25%) qu'il hérite des deux gènes normaux des parents sur les deux chromosomes de la paire.
Que signifient les termes homozygotes et hétérozygotes?
Un bébé porteur d’une copie d’un gène muté sur un seul chromosome de la paire, hérité d’un seul parent, la copie du gène sur l’autre chromosome de la paire étant normale est dit hétérozygote.
Un nouveau-né qui a hérité des copies des deux gènes mutés, un de chaque parent, sur les deux chromosomes de la paire est dit homozygote, si les gènes mutés sont les mêmes.
Un nouveau-né qui a hérité des copies des deux gènes mutés, un de chaque parent, sur les deux chromosomes de la paire est dit composé homozygote, si les gènes mutés sont différents.
Que signifie réellement une mutation MTHFR - Que font ou ne font pas mes gènes?
SNPs qui sont testés actuellement pour :
• MTHFR C677T
• MTHFR A1298C
Les mutations C677T et A1298C provoquent une régulation négative de l’activité de l'enzyme fabriquée par les gènes MTHFR. Dans le cas de ces 2 gènes, cela équivaut approximativement à ce qui suit:
MTHFR C677T hétérozygote = perte de fonction de 30 à 40%
MTHFR C677T homozygote = 60 à 70% de perte de fonction
MTHFR A1298C hétérozygote = quelques % de perte de fonction ou 20% de perte de fonction
(recherche non connue) - La recherche n'est PAS claire
MTHFR A1298C homozygote = perte de fonction de 40%
MTHFR C677T et MTHFR A1298C hétérozygote = composé hétérozygote = de 40 à 50% de perte
de fonction.
Cependant, même à l'état homozygote, aucune de ces variations n'est assez forte pour provoquer toutes les pertes de fonction de l’enzyme MTHFR mentionnées ci-dessus. Cela signifie qu'un patient qui est génétiquement, ou autrement, prédisposé à développer ces pertes de fonction ne le fera pas tant qu'il n'aura pas vécu un événement déclencheur. Malheureusement, un grand nombre de facteurs peuvent agir comme un événement déclencheur, des vaccins (virus vivants) aux infections sévères, aux expositions environnementales, aux traumatismes et aux opérations chirurgicales, en passant par des états émotionnels tels que le stress.[4]
Les polymorphismes de l'enzyme MTHFR à un seul nucléotide (SNP) C677T (rs1801133) et A1298C (rs1801131)[5]
L'enzyme appelée méthylènetétrahydrofolate réductase est codée par le gène portant le symbole MTHFR sur l'emplacement du chromosome 1 p36.3 chez l'homme. Il existe des variantes de séquence d'ADN (polymorphismes génétiques) associés à ce gène (En 2000, un rapport a porté le nombre de polymorphismes à 24). Deux parmi les plus étudiés sont les polymorphismes à un seul nucléotide (SNP) C677T (rs1801133) et A1298C (rs1801131).
Le polymorphisme à un seul nucléotide C677T SNP (Ala222Val)
Article principal: rs1801133.
Le nucléotide MTHFR en position 677 dans le gène a deux possibilités: C (cytosine) ou T (thymine). C en position 677 (conduisant à une alanine à l'acide aminé 222) est l'allèle normal. L'allèle 677T (conduisant à une substitution de valine au niveau de l'acide aminé 222) encode une enzyme thermolabile à activité réduite.
Les individus avec deux copies de 677C (677CC) ont le génotype le plus commun. Les individus 677TT (homozygotes) ont une activité MTHFR inférieure à celle des individus CC ou CT (hétérozygotes). Environ dix pour cent de la population nord-américaine est T-homozygote pour ce polymorphisme. Il existe une variabilité ethnique dans la fréquence de l'allèle T - la fréquence en Méditerranée / Hispaniques est supérieure à la fréquence en Caucasiens qui, à son tour, est plus grande que chez les Africains / Afro-Américains.
Le degré de thermolabilité des enzymes (évalué comme activité résiduelle après inactivation par la chaleur) est beaucoup plus élevé chez 677 TT (18–22%) que chez 677CT (56%) et 677CC (66–67%). Les individus de 677TT sont prédisposés à une hyperhomocystéinémie modérée (taux élevés d'homocystéine dans le sang), car ils ont moins de MTHFR actif pour produire du 5-méthyltétrahydrofolate (utilisé pour diminuer l'homocystéine). De faibles apports alimentaires en acide folique peuvent également provoquer une hyperhomocystéinémie légère.
Une faible consommation de folate affecte davantage les individus du génotype 677TT que ceux du génotype 677CC/CT. 677TT (mais pas 677CC/CT) chez les patients ayant des taux plasmatiques de folate plus faibles sont à risque de présenter des taux plasmatiques d'homocystéine plus élevés. Dans les études sur le MTHFR recombinant humain, la protéine encodée par le 677T perd son cofacteur FAD trois fois plus vite que la protéine de type primitif. Le 5-méthyl-THF ralentit le taux de libération de FAD dans les enzymes tant primitives que mutantes, bien que ce soit beaucoup plus dans l'enzyme mutante. Le faible état en folate avec la perte de FAD qui en résulte améliore la thermolabilité de l'enzyme, fournissant ainsi une explication aux niveaux normalisés d'homocystéine et de méthylation de l'ADN chez les individus 677TT ayant suffisamment de folate.
Ce polymorphisme et une hyperhomocystéinémie modérée sont associés à des anomalies du tube neural chez la progéniture, à un risque accru de complications de la grossesse, d’autres complications de la grossesse, de thromboses artérielles et veineuses et de maladies cardiovasculaires. Les sujets 677TT courent un risque accru de leucémie aiguë lymphoblastique et de cancer du côlon.
Les mutations du gène MTHFR pourraient être l'un des facteurs d'augmentation du risque de développer la schizophrénie. Les patients schizophrènes ayant l'allèle de risque (T\T) présentent davantage de carences dans les tâches de la fonction exécutive.
Remarque :
Les fonctions exécutives (collectivement appelées fonction exécutive et contrôle cognitif) sont un ensemble de processus cognitifs nécessaires au contrôle cognitif du comportement : sélectionner et surveiller avec succès des comportements facilitant la réalisation des objectifs choisis. Les fonctions exécutives comprennent les processus cognitifs de base tels que le contrôle de l'attention, l'inhibition cognitive, le contrôle inhibiteur, la mémoire de travail et la flexibilité cognitive. Les fonctions exécutives d'ordre supérieur nécessitent l'utilisation simultanée de plusieurs fonctions exécutives de base et incluent la planification et l'intelligence fluide (par exemple, le raisonnement et la résolution de problèmes).
Les fonctions exécutives se développent et changent progressivement tout au long de la vie d'un individu et peuvent être améliorées à tout moment au cours de la vie d'une personne. De même, ces processus cognitifs peuvent être affectés négativement par divers événements qui affectent un individu. Les tests neuropsychologiques (par exemple, le test de Stroop) et les échelles d’évaluation (par exemple, l’inventaire de la fonction d’évaluation du comportement) sont utilisés pour mesurer les fonctions exécutives. Elles sont généralement réalisées dans le cadre d’une évaluation plus complète visant à diagnostiquer les troubles neurologiques et psychiatriques.
Le contrôle cognitif et le contrôle de stimulus, associés aux conditionnements opérant et classique, représentent des processus opposés (internes vs. externes ou environnementaux, respectivement) qui se disputent le contrôle des comportements suscités de la part d’un individu, en particulier, un contrôle inhibiteur est nécessaire pour neutraliser les premières réponses comportementales induites par le stimulus (contrôle du comportement par le stimulus). Le cortex préfrontal est nécessaire mais pas uniquement suffisant pour les fonctions exécutives, par exemple, le noyau caudé et le noyau sous-thalamique jouent également un rôle dans la régulation du contrôle inhibiteur.
Le contrôle cognitif est altéré dans les dépendances, le trouble d'hyperactivité avec déficit de l'attention, l'autisme et plusieurs autres troubles du système nerveux central. Les réponses comportementales induites par les stimuli associées à un stimulus gratifiant particulier tendent à dominer le comportement d'une personne toxicomane.[6]
Le génotype C677T était associé à un risque accru de perte de grossesse récurrente chez les non-Caucasiens, mais ce lien a été réfuté au cours des dernières années. Les directives de recommandation de l'American College of Medical Genetics indiquent actuellement que les personnes avec une interruption de grossesse récurrente ne doivent pas être testées pour les variantes du gène MTHFR.
Il existe également un lien provisoire entre les mutations du MTHFR et la démence. Une étude menée auprès d'une population japonaise âgée a révélé des corrélations entre la mutation MTHFR 677CT, un polymorphisme de l'Apo E et certains types de démence sénile. D'autres recherches ont montré que les personnes présentant des mutations liées au folate peuvent toujours présenter un déficit fonctionnel même lorsque les taux sanguins de folate sont dans les valeurs normales, et recommande de prendre un supplément de méthyltétrahydrofolate pour prévenir et traiter potentiellement la démence (et la dépression). Une étude de 2011 menée en Chine a également révélé que C677T SNP était associé à la maladie d’Alzheimer chez les populations asiatiques (mais pas chez les Caucasiens).
Le polymorphisme C677T est associé à un risque d'infarctus du myocarde chez les populations africaines, nord-américaines et âgées.
Le polymorphisme à un seul nucléotide A1298C SNP (Glu429Ala)
Au nucléotide 1298 du MTHFR, il existe deux possibilités: A ou C. 1298A (conduisant à un Glu au niveau de l’acide aminé 429) est le plus courant, tandis que 1298C (conduisant à une substitution Ala au niveau de l’acide aminé 429) est moins commun. 1298AA est l'homozygote "normal", 1298AC l'hétérozygote et 1298CC l'homozygote pour la "variante". Dans les études sur le MTHFR humain recombinant, la protéine codée par 1298C ne peut pas être distinguée de 1298A en termes d'activité, de thermolabilité, de libération de FAD ou de l'effet protecteur du 5-méthyl-THF. La mutation C ne semble pas affecter la protéine MTHFR. Il ne résulte pas de MTHFR thermolabile et ne semble pas affecter les niveaux d'homocystéine. Cependant, il affecte la conversion du MTHF en BH4 (tétrahydrobioptérine), un cofacteur important dans la production de neurotransmetteurs, et la synthèse de l'oxyde nitrique.
Certains ont commenté une "réaction inverse" dans laquelle la tétrahydrobioptérine (BH4) est produite lorsque le 5-méthyltétrahydrofolate est reconverti en méthylènetétrahydrofolate. Ceci n’est cependant pas universellement convenu. On pense que cette réaction nécessite le 5-MTHF et la SAMe. Un autre avis est que le 5-MTHF traite le peroxynitrite, préservant ainsi le BH4 existant, et qu'aucune "réaction inverse" de ce type ne se produit.
Un polymorphisme maternel MTHFR A1298C est associé à une grossesse avec le syndrome de Down. Les résultats des analyses de sous-groupes et de sensibilité ont montré que ce polymorphisme est un facteur de risque de grossesse avec le syndrome de Down dans les populations asiatiques mais pas dans la population caucasienne, ni dans la méta-analyse globale.
MTHFR A1298C peut jouer un rôle moteur dans le développement du trouble dépressif majeur ou servir de marqueur prédictif ou diagnostique, éventuellement en association avec C677T.
Détection de polymorphismes MTHFR
Une méthode tétra-primaire triplex ARMS-PCR a été développée pour la détection simultanée des polymorphismes C677T et A1298C avec le polymorphisme A66G MTRR dans une seule réaction PCR.
Déficit sévère en MTHFR
Le déficit sévère en MTHFR est rare (environ 50 cas dans le monde) et est dû à des mutations entraînant une activité enzymatique résiduelle de 0 à 20%. Les patients présentent un retard de développement, un dysfonctionnement de la motricité et de la marche, des convulsions et un déficit neurologique. Ils présentent des taux extrêmement élevés d'homocystéine dans le plasma et l'urine, ainsi que des taux plasmatiques de méthionine faibles à normaux. Cette déficience et les mutations du MTHFR ont également été associées à une paraparésie spastique récessive avec déficit complexe I.
Une étude sur la population ouïgoure en Chine a indiqué que le polymorphisme de rs1801131 dans MTHFR était associé à nsCL / P dans la population ouïgoure en Chine. Compte tenu des caractéristiques génétiques et environnementales uniques de la population ouïgoure, ces résultats pourraient être utiles pour explorer la pathogenèse de cette maladie complexe.
Épigénétique
L'hyperméthylation du promoteur aberrant MTHFR est associée à la stérilité masculine. En outre, ce phénomène épigénétique inadéquat a été observé dans des échantillons de sperme d'hommes infertiles appartenant à des couples ayant des antécédents d'avortement spontané récurrent. L'hyperméthylation inappropriée du promoteur de MTHFR peut affecter les deux rôles essentiels de la méthylation de l'ADN dans les cellules spermatogénétiques, le processus de méthylation du génome global et l'empreinte génomique des gènes paternels.
Avoir une mutation MTHFR, qu'est-ce que cela signifie?
Une mutation MTHFR signifie quelque chose de différent pour chaque individu. Il est très important de se rappeler que ce n'est pas parce que vous avez une mutation que vous aurez nécessairement des problèmes de santé - connus sous le nom de «gène» en tant qu'expression. De nombreux facteurs influencent les gènes.
Si vous avez une maladie chronique ou si vous ne vous sentez pas bien, il est probable que plusieurs facteurs aient provoqué l'expression de votre gène. Il est donc important que vous cherchiez de l'aide pour comprendre votre mutation MTHFR et y remédier.
En tant que cible de médicament
Des inhibiteurs de MTHFR et une inhibition anti-sens de l'expression de l'enzyme ont été proposés comme traitements du cancer. La forme active du folate, le L-méthylfolate, peut être appropriée pour cibler les affections affectées par les polymorphismes du MTHFR.

/image%2F2517154%2F20190326%2Fob_e5cdc3_adn-image.jpg)