L’effet Warburg : la vraie cause du cancer
Comme toute entité vivante, les cellules d’un cancer ont besoin d’énergie pour synthétiser les éléments de leur croissance. Cette énergie est chimique, elle est principalement apportée par l’adénosine triphosphate (ATP) qui, dans les cellules, est généré par l’oxydation de sucres. Cette oxydation se produit grâce à une longue chaîne d’enzymes (cycle de Krebs) situés dans de petits organites du cytoplasme de la cellule, les mitochondries. Or les mitochondries ont une origine bactérienne, dérivant d’une symbiose qui s’est produite il y a très longtemps dans l’évolution entre une cellule primitive possédant un noyau et une bactérie productrice d’énergie. Cette bactérie a perdu son indépendance mais a gardé son autonomie comme mitochondrie, tout en étant régulée par l’information venue du noyau et les autres fonctions de la cellule.
Louis Pasteur (1822-1895), le grand scientifique français, travaillait sur la levure de bière. La levure de bière permet la fermentation. Pour augmenter le nombre de micro-organismes et accélérer la fermentation, Pasteur a une idée, il diminue la teneur en oxygène. Les levures captent le sucre et se multiplient.
En effet, ne pouvant transformer ce sucre en énergie, les cellules grossissent, fermentent et, sous l’effet de la fermentation, se divisent sans cesse. «La fermentation, c’est la vie sans l’air» pour reprendre la célèbre formule de Louis Pasteur.
Otto Warburg (1883-1970) est un médecin biochimiste allemand et prix Nobel de physiologie ou médecine en 1931 pour sa découverte de la nature et du mode opératoire de l’enzyme respiratoire. Il a lu Pasteur.
Notre prix Nobel était convaincu que la fermentation était la cause du cancer. Ce que découvre Otto Warburg, ce que l’on appelle aujourd’hui l’effet Warburg, est que les cellules cancéreuses fermentent. Comme les levures privées d’oxygène, elles captent du sucre et prolifèrent. Mais, à la différence des levures qui cessent de se multiplier en présence d’oxygène, la cellule cancéreuse fermente même en présence d’oxygène. Et comme la cellule cancéreuse capte du sucre qu’elle ne peut brûler, elle excrète de l’acide lactique.
Pour Otto Warburg, le cancer est une maladie du métabolisme. Au contraire du diabète dont la cellule ne peut capter le sucre car il n’y a pas assez d’insuline, le cancer est lui gorgé de sucre. Le cancer est une maladie de la digestion cellulaire et, plus précisément, de la digestion du sucre.
Au début des années 1920, des scientifiques allemands ont démontré que la cellule tumorale captait des quantités importantes de sucre qu’elle ne pouvait pas brûler. Elle excrétait alors de l’acide lactique, c’est-à-dire du sucre partiellement dégradé. Le même phénomène s’observe dans le muscle soumis à l’effort : le muscle capte du glucose, mais s’il n’a pas assez d’oxygène pour le brûler, il rejette dans le sang de l’acide lactique, que certains scientifiques suspectent d’ailleurs d’être responsable des crampes.[1]
Toutefois, à la différence du muscle, l’apport d’oxygène au repos ne va pas diminuer la sécrétion d’acide lactique par la cellule cancéreuse. Ces idées ne sont pas neuves : elles datent des années 1920. Otto Warburg avait déjà compris que le mécanisme était bloqué et que la mitochondrie ne fonctionnait pas normalement.
Le biologiste affirmait: «Le cancer peut avoir de multiples causes. Elles convergent toutes vers la mitochondrie [qu’il appelle granule]. La mitochondrie est lésée. Le cancer ne peut brûler le sucre et sécrète de l’acide lactique même en présence d’oxygène». Le cancer, ce n’est que cela et Otto Warburg l’avait déjà compris il y a près d’un siècle!
Revenons à nos invariants présents dans tous les cancers. Nous avons compris que la cellule ne pouvait pas brûler. Elle se contente de tirer un peu d’énergie en cassant le glucose (six carbones) en deux pyruvates (3 carbones). Elle ne peut aller plus loin. Warburg avait déjà nommé et décrit ce processus de «glycolyse anaérobie» [La glycolyse est la voie de transformation du sucre en énergie ; anaérobie signifie en l’absence d’oxygène]: au lieu de produire 32 molécules d’ATP par molécule de glucose, la synthèse n’en produit que deux. Le rendement s’effondre (voir figure 1).

Figure 3.a : Cellule saine: la mitochondrie fonctionne: l’énergie est créée à partir du glucose.
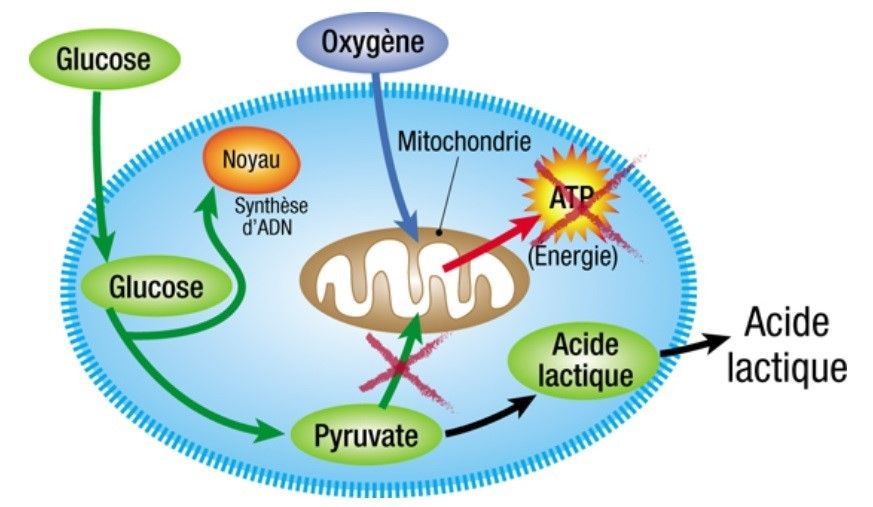
Figure 3.b : Le cancer est une maladie de la digestion cellulaire et, plus précisément, de la digestion du sucre.
Cellule cancéreuse: la mitochondrie est lésée: la cellule ne peut plus brûler le glucose pour en faire de l’énergie. Le glucose est utilisé pour synthétiser de l’ADN et des protéines (voie de synthèse) et de l’acide lactique est excrété en excès. C’est l’effet Warburg.
La mitochondrie brûle et produit de l’énergie, de l’eau et du gaz carbonique, nous l’avons compris. Le gaz carbonique n’est pas un gaz inerte: combiné avec de l’eau, il produit de l’acide carbonique. Et, comme l’ont démontré les scientifiques spécialistes du climat, l’excès de gaz carbonique est responsable de l’acidification des océans. De la même façon, si la mitochondrie est lésée dans le cancer, elle n’acidifie pas la cellule. La cellule cancéreuse apparaîtra donc basique et rouge aux anatomopathologistes (médecins spécialisés dans l’analyse des tissus) qui la colorent (justement avec un produit acide et rouge). À l’examen microscopique, la cellule cancéreuse va ainsi se révéler plus alcaline, son noyau sera plus gros, les chromosomes seront plus étalés, car moins condensés. Les charges logées dans la paroi de la membrane seront moins nombreuses, car la cellule manque d’énergie pour maintenir les gradients. La cellule cancéreuse sera plus grosse parce que l’eau diffuse et occupe tout l’espace.
Pour survivre, la cellule cancéreuse n’a pas d’autre choix que d’ouvrir grand les pores pour capter du sucre. C’est aussi ce qu’observe l’oncologue au PET-scan lorsqu’il injecte du glucose «marqué» à son patient. Comme la cellule synthétise à partir du glucose pour créer un peu d’énergie et survivre, elle grossit et finit par se diviser. Mais on sait que la cellule ne peut brûler, ce qui accroît la pression dans l’espace confiné de l’organe. Sous la pression, le cancer devient dur. La cellule tumorale ainsi comprimée va être poussée à s’échapper de l’épithélium qui l’a vu naître. Comme un animal acculé dans un espace exigu, elle n’a d’autre issue que celle de la fuite.
On pourrait comparer l’épithélium aux pavés qui recouvrent encore certaines rues de Paris. Et sous les pavés-épithélium, non pas la plage... mais la lumière des organes (les bronches, la vessie ou le tube digestif, etc.). Le cancer s’organise comme se montaient les barricades de mai 1968: les pavés sont empilés les uns sur les autres avant de fuser dans les tissus alentour jusqu’à ressembler à ces images fractales (ou étoilées) déjà évoquées. Ce cancer va essaimer à distance, sous forme de métastases qui vont se loger et coloniser les tissus lointains tels que le foie, le cerveau ou les os.
En clair, le cancer résulte d’une mitochondrie inefficace. La cellule ne peut brûler et donc grossit. Elle ne produit ni ATP ni gaz carbonique. Le cancer, ce n’est que cela.
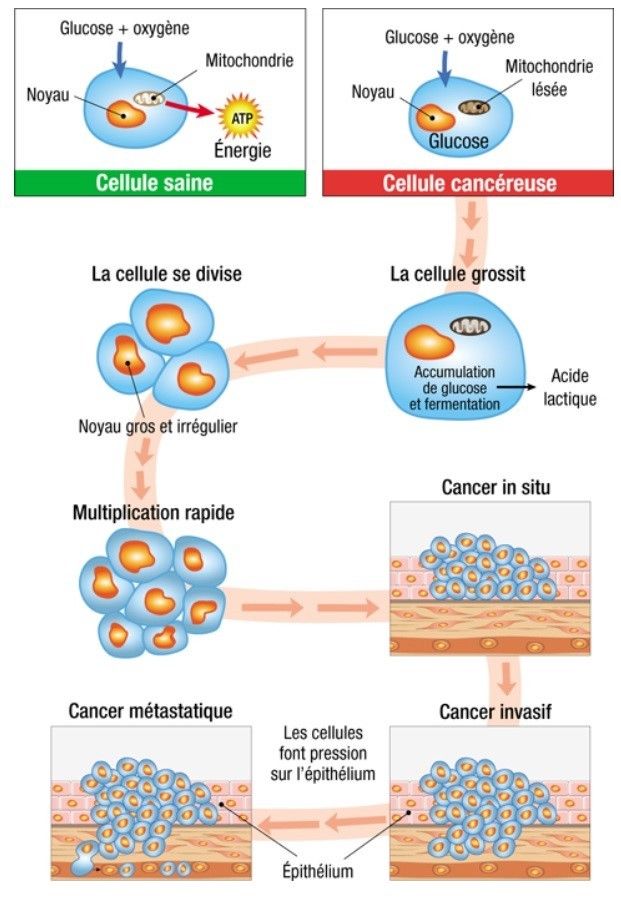
Figure 2 : mécanisme de développement d’un cancer
La cellule cancéreuse apparaîtra basique et rouge aux anatomopathologistes (médecins spécialisés dans l’analyse des tissus) qui la colorent (justement avec un produit acide et rouge). À l’examen microscopique, la cellule cancéreuse va ainsi se révéler plus alcaline, son noyau sera plus gros, les chromosomes seront plus étalés, car moins condensés. Les charges logées dans la paroi de la membrane seront moins nombreuses, car la cellule manque d’énergie pour maintenir les gradients. La cellule cancéreuse sera plus grosse parce que l’eau diffuse et occupe tout l’espace.
[1] L’excès de sucre peut ainsi contribuer à l’apparition de crampes nocturnes. Je l’ai constaté plusieurs fois par moi-même, par exemple, après consommation de quatre cuillerées à café bombées de miel de Manuka, de 12 à 14 carreaux de chocolat à 60% de cacao, de deux bananes et sauce tomate du commerce, en une journée.
La fermentation lactique et son utilisation dans la fabrication du yaourt[1]
Cet article présente le mécanisme de production d’énergie dans une cellule, par fermentation lactique (elle assure, en milieu anaérobie, un renouvellement des cofacteurs chimiques nécessaires). Il en présente également une application dans l’alimentation humaine par l’utilisation de bactéries capables de réaliser cette fermentation, à partir des glucides du lait.
1. La production d’ATP dans une cellule
La forme d’énergie directement utilisable par la cellule est, dans son immense majorité, l’énergie de liaison phosphate-phosphate de la molécule d’ATP (qui est une liaison de type anhydride phosphorique). Cependant, la réserve d’énergie contenue dans toutes les molécules d’ATP d’une cellule est extrêmement faible, à peine suffisante pour assurer ses besoins énergétiques pendant quelques secondes. Par conséquent, les molécules d’ATP doivent être régénérées sans délai au fur et à mesure de leur utilisation. Pour cela, la cellule utilise des nutriments dont l’oxydation va permettre de libérer l’énergie nécessaire à la synthèse d’ATP à partir d’ADP et de phosphate inorganique.
En présence d’oxygène, les organismes aérobies sont capables d’oxyder les glucides jusqu’à la formation d’eau et de dioxyde de carbone selon l’équation bilan :
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
(C6H12O6 est la formule du glucose, prototype du glucide simple).
Cette dégradation se fait en deux étapes, la glycolyse suivie du cycle de Krebs. Au cours de la glycolyse, une molécule de glucose à 6 carbones est coupée en deux pour donner 2 molécules à 3 carbones (l’acide pyruvique ou pyruvate) avec production de 2 molécules d’ATP. Les deux acides pyruviques sont alors oxydés plus avant dans le cycle de Krebs, avec libération de 6 molécules de CO2 et production de 2 molécules d’équivalent ATP. Mais au cours de ces deux étapes, et contrairement à ce que l’on pourrait penser, les atomes d’hydrogène de la molécule de glucose ne vont pas être utilisés pour former de l’eau : ils vont être captés par deux cofacteurs, le NAD+ et le FAD, qui vont servir d’intermédiaires. En effet, ces cofacteurs captent les hydrogènes du glucose et passent sous la forme NADH+H+ et FADH2. C’est dans un troisième temps, dans la chaîne respiratoire, que ces molécules vont revenir à leur état initial (le NAD+ et le FAD), en cédant leurs hydrogènes qui vont alors former des molécules d’eau en se combinant avec des atomes d’oxygène fournis par le dioxygène. Au passage, cela permet la formation de molécules d’ATP via l’établissement d’un gradient de protons qui va faire fonctionner l’ATP synthase. Une molécule de glucose permet la formation de 8 molécules de NADH+H+ et 2 molécules de FADH2 qui, elles-mêmes, permettent la formation de 32 molécules d’ATP en moyenne.
2. Le rôle de la fermentation lactique
On vient de voir que la production d’ATP liée à l’oxydation du glucose fait intervenir des cofacteurs initialement oxydés (NAD+ et FAD) qui passent à l’état réduit (NADH+H+ et FADH2) avant de revenir à leur état initial, c’est pourquoi ils n’apparaissent pas dans l’équation bilan, même s’ils sont indispensables d’un point de vue réactionnel. Pour que glycolyse et cycle de Krebs puissent se dérouler, il faut donc que la cellule dispose de cofacteurs oxydés (NAD+ et FAD) à même d’accepter les atomes d’hydrogène des molécules de glucose. Le stock étant limité, il faut régénérer ces molécules sans délai au fur et à mesure de leur utilisation. En présence d’oxygène, c’est par la chaîne respiratoire que s’effectue cette régénération, mais son fonctionnement nécessite du dioxygène. Or de nombreux organismes sont capables de vivre en milieu anaérobie. Et même chez l’Homme, lors d’un effort intense, les cellules musculaires peuvent fonctionner un certain temps avec un apport insuffisant en dioxygène. Il y a pourtant nécessairement régénération de l’ATP, donc oxydation de glucose, alors que la chaîne respiratoire ne peut fonctionner.
La question qui se pose est la suivante : comment régénérer la forme oxydée des cofacteurs en absence de dioxygène ?
Pour cela, il faut qu’une molécule autre que le dioxygène capte les atomes d’hydrogène des NADH+H+ (nous verrons pourquoi cette question ne se pose pas pour le FADH2). Une possibilité est d’utiliser l’acide pyruvique, qui va se transformer en acide lactique en deux étapes. L’équation bilan de cette réaction est la suivante :
C3H4O3 + NADH+H+ → C3H6O3 + NAD+
(C3H4O3 est la formule du pyruvate, C3H6O3 celle de l’acide lactique).
Cette réaction est appelée la fermentation lactique (car il y a production d’acide lactique). Une différence majeure avec la régénération du NAD+ et du FAD via la chaîne respiratoire est que cette réaction ne permet pas la production d’ATP, mais elle permet à la glycolyse de se dérouler en absence de dioxygène. On remarquera également que cette réaction utilise le produit de la glycolyse (le pyruvate), c’est pourquoi elle ne permet pas la régénération des NADH+H+ produits par le cycle de Krebs (car il n’y a pas eu de pyruvate produit pour permettre cette régénération). Donc en absence de dioxygène, si la glycolyse peut continuer à se dérouler, ce n’est pas le cas du cycle de Krebs. C’est d’ailleurs pour cela qu’on ne parle pas du FADH2 qui n’est produit que par le cycle de Krebs et pas au cours de la glycolyse.
L’acide lactique est donc le produit final de la fermentation. Au total, cela ne permet la production que de 2 molécules d’ATP par molécule de glucose, au lieu des 36 molécules d’ATP produites en présence de dioxygène. En effet, l’essentiel du pouvoir réducteur du glucose (énergie chimique contenue initialement dans la molécule) est retrouvé dans les deux molécules d’acide lactique, au lieu d’avoir été transféré dans des molécules d’ATP. Mais cela peut suffire à couvrir les besoins énergétiques de certaines cellules.
3. La fabrication du yaourt
On vient de voir qu’il était possible de produire de l’ATP à partir de glucose en absence de dioxygène, moyennant la production d’acide lactique. Dans une cellule humaine, cette situation ne peut durer longtemps. En effet, l’acide lactique ne pouvant être éliminé rapidement, il va s’accumuler dans la cellule et devenir toxique.
Il en va tout autrement pour de nombreux organismes qui peuvent parfaitement vivre en utilisant ce type de métabolisme. C’est en particulier le cas pour de nombreuses bactéries, donc certaines sont utilisées dans l’alimentation humaine depuis très longtemps, comme dans la préparation du yaourt. C’est ainsi à Pline l’ancien, qui vécut au Ier siècle après JC, que revient le premier témoignage sur une préparation comparable à du yaourt (les Barbares savent « épaissir le lait en une matière d’une agréable acidité »).
En effet, le yaourt est un aliment obtenu par fermentation lactique du lait. Le lait contient des glucides, en particulier du lactose (disaccharide composé d’un galactose et d’un glucose), qui va être utilisé par les bactéries qui, en retour, vont produire et libérer de l’acide lactique. L’acidification qui en résulte va entraîner un changement de texture (coagulation des protéines du lait) et de saveur, ceci en association avec la libération de divers autres métabolites.
Pour fabriquer du yaourt, il faut donc ensemencer du lait avec des bactéries (ce qui peut être fait tous simplement en mélangeant du lait avec un yaourt acheté ou précédemment fabriqué) et laisser la fermentation se dérouler à une température adaptée (entre 42 °C et 46 °C). De nombreuses souches bactériennes sont capables de réaliser une fermentation lactique, mais seule l’utilisation des deux souches Lactobacillus bulgaricus et Streptococcus thermophilus donne légalement droit à l’appellation “yaourt”, en France et dans de nombreux pays européens. L’utilisation d’autres souches comme Bifidobacterium sp. va permettre d’obtenir un aliment proche du yaourt, mais avec des caractéristiques de texture et de flaveur spécifiques.
4. Conclusion
Le yaourt est un exemple classique de l’utilisation d’un microorganisme dans l’élaboration d’un aliment destiné à la consommation humaine mais c’est loin d’être le seul. Pour rester dans la fermentation lactique, nous pouvons par exemple citer son utilisation dans la réalisation de fromages.
Professeur agrégé de SVT. Il a été le responsable éditorial du site Planet-Vie de 2004 à 2016.
L’ATP, molécule clef de l’énergétique cellulaire[2]
Les êtres vivants tirent leur énergie de l’oxydation des nutriments, et ceci est vrai même pour les plantes chlorophylliennes (qui utilisent l’énergie des photons pour fabriquer de la matière organique qui pourra être oxydée ultérieurement). Cependant, l’énergie libérée lors de cette oxydation n’est pas directement utilisable par les cellules. Elle est captée par un intermédiaire qui, dans l’immense majorité des cas, se révèle être l’ATP. En effet, de très nombreux évènements cellulaires ou réactions métaboliques énergétiquement défavorables peuvent se dérouler grâce à la rupture de la liaison phosphodiester riche en énergie d’une molécule d’ATP. On peut citer différents exemples comme :
- le transport actif effectué par l’ATPase sodium potassium, qui assure le maintien des déséquilibres ioniques de part et d’autre des membranes cellulaires, en permettant le passage du sodium et du potassium tous deux contre leurs gradients électrochimiques respectifs ;
- La synthèse d’acétylcholine (l’un des principaux neuromédiateurs) à partir d’acétate et de choline selon la réaction
acétate + choline + ATP → Acétylcholine + ADP + Pi.
L’ATP est donc le donneur immédiat d’énergie libre de très loin le plus important dans les systèmes biologiques. Ce rôle d’intermédiaire, couplé au fait que les stocks d’ATP ne sont pas très importants, fait que cette molécule est soumise à un renouvellement intense, ce qui nécessite une production permanente, rapide et importante.
Si on fait le calcul chez l’homme, on estime que la consommation énergétique moyenne d’un individu est d’environ 8 360 kjoules (2 000 kcal) par 24 heures. Cette énergie, contenue dans les molécules organiques (généralement glucides et lipides), doit servir à fabriquer de l’ATP avant d’être utilisée par les cellules. Le rendement de cette synthèse est nécessairement inférieur à 1, de l’ordre de 0,5, le reste étant perdu sous forme de chaleur. C’est donc environ 4 180 kjoules (1 000 kcal) qui seront stockés transitoirement dans les molécules d’ATP puis utilisés par les cellules.
Or, l’hydrolyse d’une mole d’ATP fournit 30,5 kjoules (7,3 kcal) dans les conditions standard (concentration des différents composés intervenants de 1 M) mais près de 50 kjoules (12 kcal) en conditions physiologiques ( ref. 1). Les 4 180 kjoules fournis aux cellules correspondent donc à l’hydrolyse de 83,6 moles d’ATP, soit environ 46 kg. Sachant que le stock d’ATP/ADP, pour tout l’organisme, est d’environ 0,1 mole (autour de 50 g), cela implique qu’il soit renouvelé 920 fois par jour, soit approximativement une fois toutes les 1,5 minutes. Cette valeur est une moyenne pour un organisme et peut être largement inférieure pour une cellule, en cas de très forte demande énergétique (typiquement une cellule musculaire lors d’un effort intense), pour se chiffrer en secondes.
Ce calcul est bien sûr basé sur de nombreuses approximations et le résultat n’est pas à prendre comme un chiffre exact, mais il donne un ordre de grandeur et permet de conclure qualitativement que l’ATP est une molécule possédant un turnover extrêmement rapide.
L’ATP intervient dans de nombreuses voies de régulation
L’ATP participe largement à la régulation, et ceci à travers plusieurs mécanismes.
Le premier correspond à la phosphorylation. Par définition une réaction de phosphorylation correspond à l’ajout d’un groupement phosphate sur une molécule, ce groupement phosphate provenant d’un ATP qui sert alors de donneur. Les enzymes catalysant ce type de réaction sont appelées des kinases. Précisons qu’il faut distinguer cette réaction de la phosphatation, qui correspond également à un ajout d’un groupement phosphate sur une molécule mais à partir d’un phosphate inorganique. Les enzymes catalysant ce deuxième type de réaction sont appelées phosphorylases (les phosphatases sont des enzymes qui enlèvent un groupe phosphate d’une molécule).
Les phosphorylations ont souvent un impact sur l’activité des molécules ainsi phosphorylées. Le cas le plus classique est une activation ou une inhibition de l’activité d’une enzyme. On peut citer pour exemple la glycogène synthase, enzyme impliquée dans la synthèse du glycogène, qui est inactive à l’état phosphorylé et active à l’état déphosphorylé. Mais il est amusant de constater que la glycogène synthase kinase, l’enzyme qui phosphoryle la glycogène synthase, est, elle, inactive à l’état déphosphorylé et active à l’état phosphorylé. Il n’y a donc pas de règle entre état phosphorylé/déphosphorylé et activation/inactivation.
Un autre exemple qui démontre parfaitement cela provient de l’enzyme Cdk1 impliquée dans le contrôle du cycle cellulaire, en particulier de la transition phase G2/mitose. L’activité de la Cdk1 (Cyclin Dependant Kinase 1, Kinase 1 dépendante d’une cycline) est régulée par son association avec la cycline B, mais également par des phosphorylations. Cette molécule possède 3 sites de phosphorylation, dont deux sont inhibiteurs (Thr 14 et Tyr 15) et un activateur (Thr 161). Pour que l’enzyme soit active, il faut donc qu’elle soit associée à la cycline B, mais également qu’elle soit à la fois phosphorylée sur la Thr 161 et déphosphorylée sur les Thr 14 et Tyr 15.
Enfin les phosphorylations peuvent également réguler des molécules autres que des enzymes. Ainsi la phosphorylation de la chaîne légère de la myosine par la MLCK (Myosine Light Chain Kinase, kinase de la chaîne légère de la myosine) permet l’interaction actine-myosine et la contraction musculaire dans le muscle lisse.
L’ATP peut également intervenir directement dans la régulation de l’activité de certaines enzymes en tant qu’effecteur allostérique. D’une manière générale, un effecteur allostérique est une molécule qui se lie à une enzyme sur un site spécifique, qui ne participe pas à la réaction chimique catalysée, mais qui va modifier l’affinité de l’enzyme pour les substrats et du coup modifier son activité. Par définition, un effecteur allostérique ne peut exister que pour des enzymes allostériques, dont possédant plus d’une seule sous-unité. L’ATP est un effecteur allostérique classique de nombreuses enzymes intervenant dans le métabolisme, ce qui peut être interprété comme le moyen d’adapter finement et extrêmement rapidement l’activité métabolique à l’état énergétique des cellules.
On peut prendre l’exemple de la PFK (PhosphoFructoKinase) qui catalyse la réaction Fructose 6 Phosphate + ATP → Fructose 1,6 Diphosphate + ADP. Elle fait partie de la glycolyse et correspond à l’étape d’engagement des glucides dans la voie de production d’énergie, on parle d’enzyme-clé. A ce titre elle est donc finement régulée. C’est une enzyme tétramèrique (constituée de 4 sous-unités). L’ATP est un effecteur allostérique de cette enzyme. Pourtant c’est aussi un substrat. Mais l’ATP-substrat et l’ATP-effecteur allostérique se fixent sur des sites différents. L’ATP agit comme un inhibiteur de cette réaction, l’interprétation étant la suivante : lorsque la charge énergétique de la cellule est forte (rapport ATP/ADP élevé) il n’est pas nécessaire de produire beaucoup d’ATP. L’inhibition de la première étape qui mène vers la production d’ATP par l’ATP lui-même (via la glycolyse – le cycle de Krebs – et la chaîne de transporteurs d’électrons) va donc entraîner une diminution de cette production. Inversement, lorsque la charge énergétique de la cellule est faible (rapport ATP/ADP faible) il est nécessaire de produire beaucoup d’ATP. Comme la concentration en ATP est faible, il va y avoir une levée d’inhibition, ce qui revient à une activation de cette réaction et, par suite, de la production d’ATP.

/image%2F2517154%2F20190326%2Fob_e5cdc3_adn-image.jpg)