Vitamine D : métabolisme, régulation, homéostasie phosphocalcique, minéralisation osseuse, ostéoporose, ostéomalacie, rachitisme héréditaire, neuroprotection, immunité, diabète, cancer, psoriasis[1]
La vitamine D est connue depuis longtemps pour son rôle primordial dans le contrôle de l’homéostasie phosphocalcique et dans la minéralisation osseuse. Le rôle physiologique de cette hormone dans l’immunité, la différenciation cellulaire, la prolifération et la neuroprotection a été mis en évidence plus récemment.
Les enzymes de type cytochromes P450 (CYP27A1, CYP2R1, CYP27B1 et CYP24A1) et le récepteur nucléaire VDR sont les principaux acteurs qui jouent un rôle majeur dans le contrôle du métabolisme de la vitamine D. La production de vitamine D a pu être mise en évidence dans d’autres tissus (placenta, cerveau, prostate, peau). Les fonctions physiologiques de cette synthèse locale sont encore en cours d’étude.
Un manque de vitamine D entraîne un rachitisme chez l’enfant ainsi qu’une exacerbation de l’ostéoporose et le développement d’une ostéomalacie chez l’adulte.
Le rachitisme pseudo-carentiel de type I résulte d’une anomalie de l’expression du gène codant CYP27B1. Le taux de 25(OH)D3 est normal chez les individus atteints du rachitisme pseudo-carentiel de type I alors que le taux de 1,25(OH)2D3 s’effondre. Des déformations et douleurs osseuses, un retard de croissance et une myasthénie caractérisent la maladie. L’administration de 1,25(OH)2D3 est nécessaire pendant toute la vie des personnes atteintes de cette affection. À l’inverse, le rachitisme pseudo-carentiel de type II résulte d’une anomalie de l’expression du gène codant VDR. Il se caractérise donc par une résistance des organes cibles à l’action de 1,25(OH)2D3 dont le taux est élevé. Ce rachitisme pseudo-carentiel de type II se manifeste par un tableau de rachitisme sévère et précoce, associé à une alopécie dans 80 % des cas. Le traitement consiste en l’administration de doses massives de tous les dérivés de la vitamine D3 et de calcium.
L’allongement de la durée de vie et l’incidence des fractures provoquées par l’ostéoporose ont fait de cette affection un problème de santé publique très actuel. De plus, une grande partie de la recherche sur la vitamine D a trait au développement de l’utilisation du 1,25(OH)2D3 comme agent prévenant ou retardant la survenue de certaines maladies auto-immunes (diabète de type 1) ou prolifératives (cancers solides, leucémie, psoriasis).
RÉSUMÉ
La vitamine D est bien connue comme une hormone impliquée dans le métabolisme minéral et la croissance osseuse. La conversion en métabolite actif 1,25-dihydroxyvitamine D3 (1,25(OH)2D3) à partir du précurseur est effectuée par les enzymes du cytochrome P450 dans le foie (CYP27A1 et CYP2R1) et le rein (CYP27B1). Il a été démontré que le CYP27A1 est régulé par la transcription par des récepteurs nucléaires (PPARα, γ, HNF-4α et SHP) qui sont des facteurs de transcription dépendants du ligand. CYP27B1 est étroitement réglementé par le taux plasmatiques de calcium, phosphate, hormone parathyroïdienne (PTH) et 1,25(OH)2D3 lui-même. Dans les organes cibles de la vitamine D, l'inactivation de la vitamine D est attribuée au CYP24A1 qui est induit par la transcription 1,25(OH)2D3 dont l'action est médiée par la liaison à son récepteur nucléaire apparenté, le récepteur de la vitamine D (VDR).
Maladies associées à la vitamine
Déficit en D (rachitisme chez les enfants et ostéomalacie ou ostéoporose adultes) et les formes autosomiques récessives de rachitisme héréditaire illustrent le rôle clé de la vitamine D dans l'homéostasie calcique et le métabolisme osseux. Récemment, découverte de nouvelles actions biologiques 1,25(OH)2D3 qui comprennent un effet antiprolifératif et pro-différenciant sur de nombreux types de cellules et les propriétés immuno-régulatrices suscitent un intérêt croissant pour cette vitamine. De cette manière, une meilleure compréhension des différents acteurs impliqués dans le métabolisme de la vitamine D et sa régulation est d'une importance majeure pour optimiser l'utilisation de la vitamine D dans la prévention des maladies.
La vitamine D ou calciférol est essentielle au maintien de l’homéostasie phosphocalcique de l’organisme. C’est la forme active de cette vitamine, la 1,25-dihydroxyvitamine D, qui augmente la capacité d’absorption du calcium (et du phosphore) par l’intestin, diminue sa fuite urinaire et mobilise le calcium osseux. Cette hormone présente également une activité de régulation de la défense immunitaire ainsi que la capacité de moduler la différenciation et la prolifération de certains types cellulaires. La biosynthèse et la dégradation de la vitamine D sont assurées par des enzymes de type cytochromes P450 (CYP). La régulation de son métabolisme a été très étudiée au cours de ces dernières années. Les variations de la calcémie entraînent la libération d’hormones agissant sur ces CYP. La vitamine D agit aussi directement sur sa propre synthèse par une boucle de régulation négative via son récepteur nucléaire VDR (vitamin D receptor). De nombreuses études in vitro et in vivo ont démontré l’existence de ces rétrocontrôles et ont permis une meilleure compréhension des affections osseuses et endocriniennes liées au statut vitaminique D comme le rachitisme et l’ostéomalacie. Ces maladies résultent principalement du défaut d’exposition solaire et des carences d’apport alimentaire en vitamine D. Elles peuvent également être induites par l’action de médicaments sur le récepteur nucléaire PXR (pregnane X receptor) et, plus rarement, par des anomalies géniques du récepteur de la vitamine D ou d’une des enzymes de la biosynthèse de l’hormone.
Métabolisme de la vitamine D
Le terme de « vitamine D » recouvre deux composés. L’ergocalciférol, ou vitamine D2, est présent dans l’alimentation d’origine végétale (céréales mais également champignons, levures). Le cholécalciférol, ou vitamine D3, est produit par la peau sous l’action des rayons ultraviolets mais on le trouve également dans des aliments d’origine animale (poissons gras, aliments lactés enrichis). Les vitamines D2 et D3 sont utilisées dans la prévention et le traitement curatif du rachitisme. Compte tenu de l’importance de la synthèse endogène et des faibles concentrations d’ergocalciférol dans l’alimentation, les principaux dérivés proviennent de la vitamine D3 d’origine endogène.
Biosynthèse de la vitamine D3
Cette biosynthèse (Figure 1) est initiée principalement dans la peau où les rayons UVB réagissent avec le 7-déhydrocholestérol (provitamine D cutanée) pour produire la pré-vitamine D3, qui est isomérisée en cholécalciférol (ou vitamine D3). Son activation est catalysée par des CYP localisées dans les cellules hépatiques et rénales. La première étape est une hydroxylation en position 25 qui conduit à la formation de 25-hydroxyvitamine D3 (25(OH)D3), forme de réserve de la vitamine D3, et dont la demi-vie plasmatique est de deux à trois semaines. Cette hydroxylation hépatique est réalisée par des CYP situées dans le réticulum endoplasmique ou dans les mitochondries. Aujourd’hui, la CYP2R1 localisée dans les microsomes apparaît comme le candidat majeur à la synthèse de 25(OH)D3. En effet, les individus porteurs d’une mutation du gène de la CYP2R1 possèdent un taux circulant de 25(OH)D3 anormalement bas. Cependant, la CYP27A1 mitochondriale, qui intervient dans la biosynthèse des acides biliaires, la CYP2J3 et la CYP3A4 microsomales peuvent également catalyser cette hydroxylation. Du fait de l’identification encore trop récente de la CYP2R1, peu de données sont disponibles sur cette enzyme dans la littérature. Ainsi, la suite de cette revue décrira essentiellement la CYP27A1 qui est la première enzyme identifiée pouvant réaliser cette première étape hépatique. La 25(OH)D3 est ensuite prise en charge par la protéine plasmatique DBP (vitamin D binding protein) afin d’être véhiculée jusqu’au rein. L’endocytose du complexe 25(OH)D3/DBP via la mégaline est l’une des voies d’entrée dans la cellule rénale du tube contourné proximal. Les animaux ayant un défaut du gène codant la mégaline maintiennent spontanément un niveau de 1,25(OH)2D3 suffisant pour ne pas développer de rachitisme ou d’hyperparathyroïdie secondaire en cas d’apport normal de vitamine D, suggérant une entrée normale de 25(OH)D3. La seconde étape est une hydroxylation en position 1 par la CYP27B1 mitochondriale qui conduit à la 1,25-dihydroxyvitamine D3 (1,25(OH)2D3), forme biologiquement active, dont la demi-vie plasmatique est d’environ quatre heures.

Figure 1 : Schéma du métabolisme de la vitamine D3.
Dans la peau, le précurseur de la vitamine D3, le 7-déhydrocholestérol, est transformé en pré-vitamine D3 qui est secondairement isomérisée en vitamine D3 (ou cholécalciférol). Dans le foie, la 25-hydroxyvitamine D3 ou 25(OH)D3 est synthétisée à partir de la vitamine D3 après action de CYP27A1, CYP2R1, CYP2J3 ou CYP3A4. Dans les tissus cibles, la 1α-hydroxylase CYP27B1 synthétise la forme biologiquement active 1,25-dihydroxyvitamine D3 ou 1,25(OH)2D3. Son catabolisme (essentiellement dans le rein) est initié par la 24-hydroxylase CYP24A1.
À côté de cette production rénale majeure, des sites mineurs de production de 1,25(OH)2D3 ont été identifiés dans le placenta, le cerveau, la prostate, les kératinocytes, les ostéoblastes et les macrophages qui expriment CYP27B1. Cependant, cette production extrarénale ne contribue pas habituellement à la formation de 1,25(OH)2D3 plasmatique.
Une fois synthétisée, la vitamine D3 active diffuse dans l’organisme et agit sur ses organes cibles tels que l’intestin, l’os, les reins et les parathyroïdes. D’autres sites d’action ont été identifiés : l’épiderme où elle participe au maintien de l’intégrité du tissu en agissant sur la synthèse d’involucrine, une protéine majeure de la membrane cornée des kératinocytes ; le système nerveux central où elle assure une action protectrice par la synthèse de facteurs neurotrophiques. L’existence d’un métabolisme de la vitamine D3 propre à ces deux organes fait suspecter une action autocrine et/ou paracrine dans ces tissus.
Catabolisme de la vitamine D3
La concentration circulante en 1,25(OH)2D3 (vitamine D active) dépend également de son catabolisme (Figure 1) réalisé dans des cellules cibles. La CYP24A1 catalyse la conversion de 1,25(OH)2D3 en 1,24,25-trihydroxyvitamine D3 (1,24,25(OH)3D3), première étape dans la voie de dégradation de la vitamine D pour aboutir à une forme inactive, l’acide calcitroïque. Contrairement à CYP27A1 et CYP27B1, localisées principalement dans le foie et le rein respectivement, CYP24A1 est ubiquitaire, contrôlant ainsi le taux de vitamine D3 active à l’échelle de l’organisme.
Régulation du métabolisme de la vitamine D
La régulation du métabolisme de la vitamine D3 dépend essentiellement des enzymes impliquées dans sa synthèse (CYP27A1 et B1) ou son catabolisme (CYP24A1). Cette régulation fait intervenir des hormones (surtout la PTH ou parathormone) qui répondent à des variations de l’homéostasie calcique et des molécules d’origine lipidique ayant une activité autocrine ou paracrine via des récepteurs nucléaires (Figure 2).
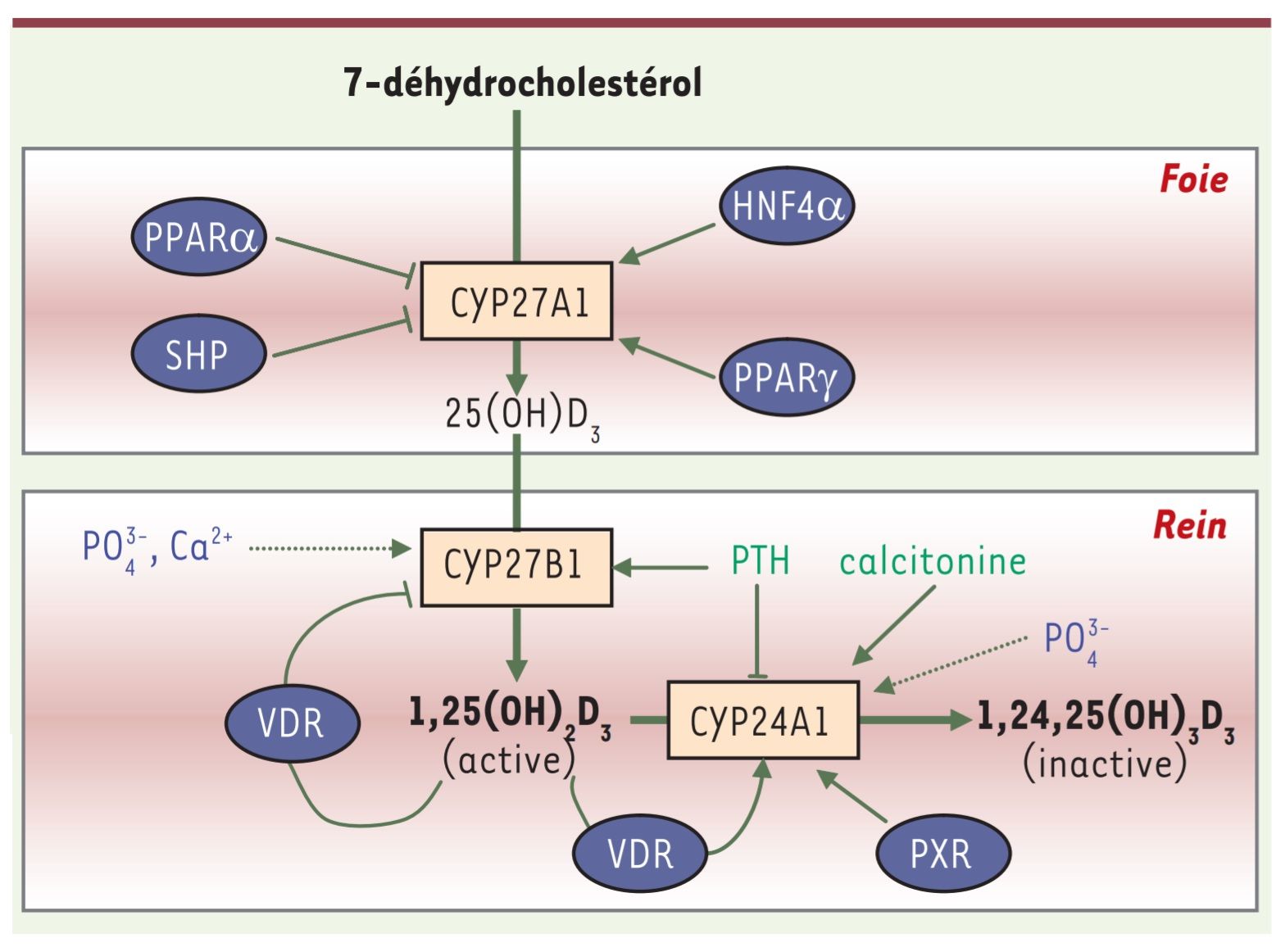
Figure 2 : Régulation du métabolisme de la vitamine D3 par les hormones, les minéraux et les récepteurs nucléaires.
Dans le foie, l’expression de la CYP27A1 est stimulée par les récepteurs nucléaires HNF4α (hepatic nuclear factor 4α) et PPARγ (peroxisome proliferator-activated receptor γ) et inhibée par PPARα et SHP (small heterodimer partner). Dans le rein, la parathormone (PTH) est le régulateur positif principal de la CYP27B1, enzyme responsable de la production de la vitamine D3 active. L’hypocalcémie et l’hypophosphatémie induisent une augmentation de l’activité et de l’expression de cette enzyme, alors que l’hypercalcémie et l’hyperphosphatémie exercent un contrôle négatif. La 1,25(OH)2D3, elle-même, via son interaction avec VDR (vitamin D receptor) inhibe l’expression rénale de la CYP27B1 et stimule la transcription de la CYP24A1 rénale, responsable de l’inactivation de la vitamine D3. La CYP24A1 est régulée également par les apports phosphatés et par la PTH. Cette dernière inhibe l’expression de l’enzyme. Au contraire, la calcitonine et le récepteur nucléaire PXR (pregnane X receptor) induisent son expression. Flèche droite, stimulation ; flèche brisée, inhibition ; flèche en pointillée : faible action de régulation.
Régulation de la synthèse
La concentration circulante de 25(OH)D3 est peu régulée. En effet, plus la quantité de vitamine D synthétisée ou ingérée est grande, plus la production de 25(OH)D3 est importante. Néanmoins, dans le foie, CYP27A1, impliquée dans sa synthèse, est modulée à l’étape transcriptionnelle par des récepteurs nucléaires. On peut citer, entre autres, PPARα et γ, dont les ligands sont des acides gras poly-insaturés, HNF4α activé par des phosphorylations et SHP, un récepteur nucléaire ayant une activité de répression transcriptionnelle. Dans le rein, l’activité de la CYP27B1, responsable de la production de l’hormone active (1,25(OH)D3), est étroitement régulée. La PTH libérée par les glandes parathyroïdes lors d’une hypocalcémie exerce un contrôle positif. À l’inverse, une hypercalcémie, une hypophosphatémie et/ou une augmentation de la concentration plasmatique en 1,25(OH)2D3 inhibent la libération de PTH. De plus, les phosphates, le calcium et la 1,25(OH)2D3 peuvent également agir directement sur l’enzyme et donc sur le taux circulant de l’hormone active. Cependant, les mécanismes moléculaires précis sont mal connus à ce jour. Le mécanisme d’autorégulation par la 1,25(OH)2D3 sera développé ci-dessous. La PTH intervient en augmentant l’activité du promoteur de la CYP27B1 via la phosphorylation du facteur de transcription CREB (cAMP-dependent response element binding protein). De nombreux autres facteurs comme l’IGF-I (insulin-like growth factor I), l’insuline, la calcitonine (hormone produite par les cellules C de la thyroïde), le FGF 23 (fibroblastic growth factor 23) interviennent également dans la régulation de la CYP27B1.
[1] Émilie Tissandié et al., Vitamine D : métabolisme, régulation et maladies associées, Médecine/Sciences 2006 ;22 : 1095-100.

/image%2F2517154%2F20190326%2Fob_e5cdc3_adn-image.jpg)