MÉTABOLISME
Le contrôle de la concentration en vitamine C dans l'organisme dépend de trois paramètres : l’absorption intestinale, la distribution tissulaire, et la réabsorption rénale.
A/ ABSORPTION INTESTINALE
L’acide ascorbique (AA) et l’acide déhydroascorbique (DHA), forme oxydée de l'acide ascorbique, sont absorbés au niveau de la lumière intestinale par les entérocytes. L’AA est absorbé par les transporteurs spécifiques SVCT1 et SVCT2, codés par les gènes Slc23a1 et Slc23a2. L’absorption d’AA par SVCT1 est saturable, dépend du sodium, du pH, de la température, et nécessite de l'énergie.
Le transporteur SVCT 1 est principalement exprimé dans l’intestin, le rein et le foie. Au niveau des cellules épithéliales intestinales et rénales le transporteur SVCT1 prédomine au niveau de la membrane apicale.
Les deux transporteurs auraient une fonction différente. SVCT2, par sa position préférentielle baso-latérale, ne contribuerait pas à l’absorption intestinale et rénale de vitamine C pour l’organisme, mais servirait à alimenter les cellules épithéliales pour leurs propres besoins.
Le transporteur SVCT2 pourrait être universellement obligatoire (vital) pour assurer l’homéostasie de la vitamine C. L’affinité de SVCT1 pour la vitamine C est plus faible que SVCT2.
Le DHA, forme oxydée de l'acide ascorbique, est absorbé par les transporteurs GLUT1 et GLUT3 avec une affinité similaire voir légèrement inférieure à celle du glucose (1–2 mM). Chez l’homme GLUT4 participe aussi au transport du DHA mais avec une affinité deux à trois fois inférieure à celle du glucose. GLUT2, GLUT5, SGLT1 ne participent pas au transport du DHA. Aucun des transporteurs du glucose ne transporte l’AA.

Figure 8 : Transport intracellulaire de la vitamine C chez les mammifères. (A) Acide ascorbique, (B) Acide dehydroascorbique (DHA)
• RÉGULATION DU TRANSPORT INTRACELLULAIRE
Différentes molécules régulent l’activité des transporteurs SVCTs et GLUTs. Le Fer joue un rôle important dans la régulation de l'absorption de vitamine C par les cellules intestinales. La vitamine C stimule l'absorption de fer en cas de déficit en fer et le fer stimule l'absorption de vitamine C en cas de déficit en vitamine C.
In vivo le transport de l’AA et du DHA dépend de la concentration en glucose. Chez le rat, le glucose diminue l’absorption de DHA par les cellules musculaires, et diminue la concentration intracellulaire d’AA. Le glucose diminue le recyclage du DHA dans les cellules musculaires mais pas dans les astrocytes.
Dans le muscle squelettique la transcription du gène codant pour la protéine SVCT2 est régulée par des substances pro-oxydantes (H2O2) ou antioxydantes (Lipoate). Dans le muscle squelettique des molécules oxygénées réactives sont naturellement produites pendant l’exercice physique, et peuvent endommager le muscle.
Dans le rein l’absorption de l’AA par SVCT1 est inhibée de manière réversible par les dérivés du benzène ou par un excès d’AA. Dans les ostéoblastes l’absorption d’AA est inhibée par les anions antagonistes du transporteur comme le 4,4’-diisothiocyanostilbene, 2,2’-acide disulfonic (DIDS), 4 acetamido-4’isothiocaynostilbene-2,2-disulfonic acid (SITS), sulfinpyrazone, et le furosemide; mais non inhibée par les anions organiques lactate, gluconate, succinate. L'aspirine (salicylate) réduite l'absorption digestive de vitamine C. Les flavonoïdes inhibent l’absorption de l’AA et de DHA car leur structure chimique est proche de la vitamine C. L’acide diclofenamique inhibe l’absorption de l’AA dans l’épithélium pigmentaire de la rétine chez l’homme.
Les endotoxines inhibent le transport de l’AA dans des fibroblastes 3T3.
Le TGF-beta augmente le transport de l’AA de 20 à 30 % dans une lignée de cellules d’ostéosarcome UMR-106.
• BIODISPONIBILITÉ
La biodisponibilité de l’AA est de 90 % pour des doses inférieures à 200 mg, 73 % pour 500 mg et 49 % pour 1250 mg. Peu de différence entre la biodisponibilité de la forme pure et celle contenue dans l’alimentation, à l’exception de la biodisponibilité augmentée de 35 % lorsque la vitamine C est contenue dans des extraits de citron.
• CONCENTRATION PLASMATIQUE
L’AA est présent dans la circulation sanguine à la concentration de 5 à 90 microM chez l’homme sain. Le DHA est rarement détectable ou alors à des concentrations très faibles (<2% de l’AA).
B/ DISTRIBUTION TISSULAIRE
L’accumulation de vitamine C varie en fonction des tissus. Les tissus avec la plus grande concentration en AA (pour 100 grammes de tissu) sont les glandes surrénales, l’hypophyse avec 30 à 50 mg/100 g suivis par le foie, la rate, la rétine, le pancréas, les reins, le cerveau avec entre 10 et 30 mg/100 g. Le foie, par sa taille, constitue la plus grosse réserve de vitamine C de l’organisme.
Chez l’homme il est difficile d’étudier la relation entre les apports alimentaires et la concentration tissulaire. Dans une étude réalisée avec des doses graduées de vitamine C (de 0,2 à 10 mg/100 g de poids), l’augmentation de la saturation tissulaire dépend de l’apport ; c'est le cas dans le cœur, le cerveau, la rate, les leucocytes, et les glandes surrénales. Lorsqu’on examine les études chez l’animal, on note une tendance similaire, plus les apports sont élevés plus la concentration tissulaire est élevée.
Une étude de la National Institute of Health a étudié la relation entre l’apport alimentaire en AA et la concentration intraleucocytaire. Chez le sujet jeune en bonne santé la saturation intracellulaire intervient avec une prise 100 mg pour atteindre une concentration (1-4 mM) 14 fois supérieure à celle du plasma.
C/ EXCRÉTION RÉNALE
Dans toutes les espèces étudiées, l’AA est filtré et réabsorbé. Chez l’homme la concentration maximale en vitamine C est régulée par la réabsorption rénale. Le taux de réabsorption tubulaire maximum analysé chez l’homme et la femme, à différents âges, est relativement constant entre les groupes, proche de 1,5 mg/100 ml filtré. Comme dans l’intestin, le transport de l’AA dans le rein dépend du Na+. Le transport est saturable et partiellement inhibé par le glucose. La réabsorption tubulaire dépend probablement également de la concentration tubulaire en AA.
Seuil d'excrétion urinaire : chez le sujet jeune en bonne santé, l’AA est détecté dans les urines pour des apports oraux supérieurs ou égaux à 100 mg/j, correspondant à une concentration plasmatique moyenne de 55-60 microM. À ces doses, les lymphocytes, neutrophiles et monocytes sont saturés à 100%, et le plasma est saturé à 70 % environ. Le plasma est saturé à 100 % avec un apport de 1 000 mg de vitamine C par jour. Une dysfonction rénale peu potentiellement affecter profondément le métabolisme de la vitamine C, ainsi en cas de maladie rénale on observe une relation inverse entre la clairance de la créatinine et l’excrétion urinaire d’AA.
En résumé :
Le contrôle de la concentration intracellulaire et extracellulaire en ascorbate dépend de trois mécanismes : l’absorption intestinale, le transport tissulaire, et la réabsorption rénale. Chez le sujet jeune en bonne santé, premièrement l’absorption intestinale diminue pour des doses > 200 mg, ce qui correspond à une concentration plasmatique d’environ 60 microM. Deuxièmement, à cette concentration, le transporteur tissulaire SVCT2 approche la Vmax et les tissus semblent être saturés. Troisièmement, aux environs de 60 microM la réabsorption rénale est proche de la saturation, et l’excès d’ascorbate est excrété dans les urines. Ces 3 mécanismes fonctionnent de manière coordonnée, assurant un contrôle précis du métabolisme de la vitamine C chez le sujet sain.
OXYDO-RÉDUCTION
L’AA cède ses électrons aux enzymes et aux composés chimiques oxydés. L’acide ascorbique est oxydé de manière réversible en radical ascorbyl (ou acide semi-dehydroascorbate), oxydé ensuite en acide dehydroascorbique (DHA) (Fig.13). Les radicaux libres intermédiaires sont relativement non réactifs. Inversement, l’acide dehydroascorbique (DHA) peut être réduit en AA en passant par les métabolites intermédiaires identiques. Il peut aussi être hydrolysé de manière irréversible en acide diketogulonic. Celui-ci est ensuite métabolisé en oxalate, xylose, acide xylonique, et acide lynxonique. L’acide dehydroascorbique (DHA) est instable en solution aqueuse avec une demi-vie à 37° C de 6 à 20 minutes en fonction de la concentration plasmatique.
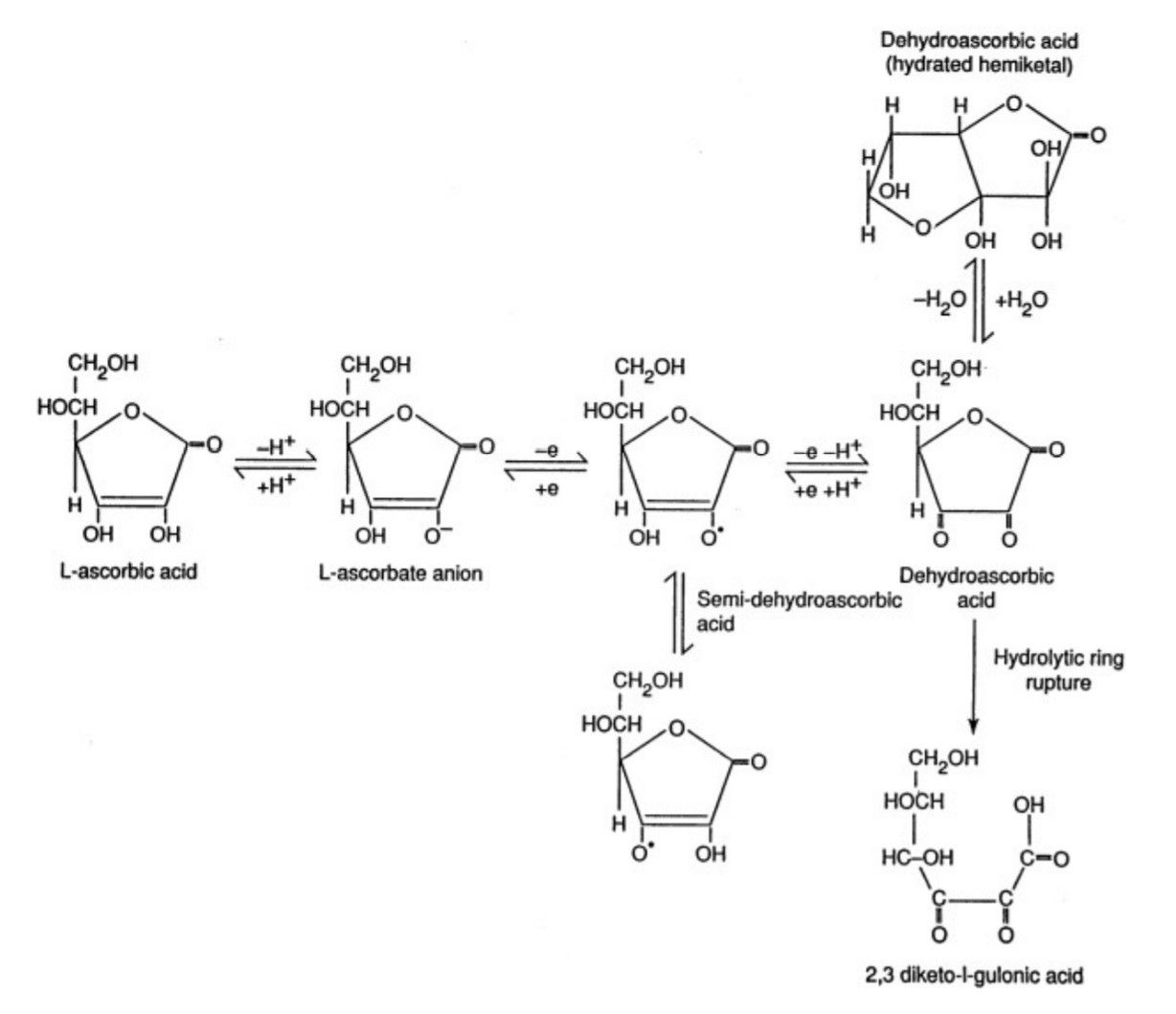
Fig.13 : Acide ascorbique et produits d'oxydations.
Les études montrent que l’AA peut être régénéré au niveau des membranes cellulaires et/ou du cytoplasme, par des voies enzymatiques ou non enzymatiques.
• Réduction membranaire :
May a montré en 2001 qu’il existe un système de réduction membranaire de l’ascorbate, NADH-dépendant. Ce système de réduction ne concerne pas le DHA mais le radical ascorbyl, premier stade d’oxydation de l’AA. Le radical ascorbyl est réduit par la semi-dehydroascorbate réductase, NADH-dépendante. Intervenir à un stade précoce permet ainsi des économies d'énergies pour la cellule. Augmenter la concentration d’ascorbate au niveau membranaire, là où la cellule reçoit de nombreuses attaques radicalaires permet à l’AA de recycler « localement » la vitamine E et de prévenir la peroxydation lipidique efficacement.
• Réduction cytoplasmique :
De nombreux tissus peuvent réduire le DHA en AA. Le DHA peut être réduit en ascorbate par le glutathion et l’acide lipoïque et/ou par la thioredoxine reductase, et la glutaredoxine (glutathion dépendante). La glutaredoxine pourrait être responsable de 80 % de l’activité de réduction du DHA intracellulaire. On retrouve la glutaredoxine dans le placenta humain, le foie de cochon, et le thymus de bovin. D’autres protéines ont une activité DHA réductase, notamment dans le placenta humain : la disulfide isomérase; la 3-a-hydroxysteroid dehydrogenase et les cytochromes b5 reductases dans la mitochondrie.
RECYCLAGE DE L’ACIDE ASCORBIQUE
Le DHA est recyclé dans la cellule suivant le schéma suivant :

Fig. 14 : Recyclage de l’AA et du DHA dans un PN neutrophile humain.
Dans ce modèle, le transport de l’AA et du DHA dépend de la disponibilité des substrats. Dans des conditions physiologiques l’AA est le seul substrat disponible dans la circulation et le milieu extracellulaire. En état de stress oxydatif, l’AA s’oxyde, la concentration en DHA augmente. Dans le sang le DHA est rapidement transporté et réduit dans les érythrocytes riches en GLUT1, en glutathion, et en glutaredoxines. Ce qui est cohérent avec l’absence de détection du DHA dans le plasma humain en situation physiologique.
Le DHA formé dans le milieu extracellulaire est aussi transporté et réduit dans les cellules voisines. La réduction du DHA intracellulaire produit un gradient de concentration favorisant son entrée dans la cellule. L’AA étant exporté lentement hors de la cellule, une concentration intracellulaire importante en AA peut être maintenue.
Ce phénomène est bien décrit dans des expériences effectuées sur des PN neutrophiles. Lorsqu’un PN neutrophile est activé, des molécules oxygénées réactives (ROS) sont produites. L’AA extracellulaire oxydé en DHA est rapidement transporté dans les cellules et immédiatement réduit en AA (fig. 10). Ainsi la concentration intracellulaire d’AA est multipliée par dix. Dans les PNN activés le transport de l’AA continue mais plus lentement que le transport du DHA. Le transport du DHA a lieu en contexte inflammatoire. En effet, l’exposition de PN neutrophiles à des bactéries, en présence d’AA, est un inducteur puissant du recyclage de l’AA, et entraîne une augmentation de la concentration intracellulaire d’AA multipliée par trente comparé au groupe contrôle.
Il existe plusieurs avantages au recyclage de l’AA. Dans les PN neutrophiles le recyclage du DHA permet une augmentation importante de la concentration en AA, en parallèle de la production de molécules pro-oxydantes. Les molécules oxydantes sont produites dans les phagosomes, sur la surface externe des membranes cellulaires, ils s’infiltrent également dans le cytosol et l’espace extracellulaire. Une concentration élevée en AA dans les PNN les protège contre les molécules oxygénées réactives intracellulaires, partie intégrante de l’activité microbicide. Prolonger la survie des neutrophiles permet également d’augmenter l’activité microbicide de l’organisme.
L’augmentation de la concentration intracellulaire en AA protège aussi le milieu extracellulaire, en cas d’extrusion active d’ascorbate, ou par fuite d’ascorbate intracellulaire lorsqu’un neutrophile meurt. Comme le recyclage de l’ascorbate augmente la concentration intracellulaire d’AA de manière importante, ces concentrations pourraient affecter le milieu extracellulaire en régulant la densité en PN neutrophiles et ou en limitant la diffusion d’AA au foyer inflammatoire. L’augmentation de la concentration extracellulaire en ascorbate peut aussi protéger le collagène et les cellules voisines de dommages oxydatifs. Des données dans les leucocytes, les neutrophiles et les ovocytes indiquent que le transport du DHA, à hautes concentrations, peut être limité par la capacité de la cellule à le réduire en AA.
La concentration en AA dans les liquides biologiques est diminuée en cas de stress oxydant, comme chez le fumeur, dans la polyarthrite rhumatoïde et le syndrome de détresse respiratoire aigu (SDRA) chez l’adulte.
La vitamine C est un antioxydant puissant La vitamine, hydrosoluble dans les liquides biologiques. Le potentiel de réduction de l’ascorbate et du radical ascorbyle est faible. Ils réagissent avec la plupart des radicaux libres et molécules oxydantes. Le radical ascorbyle a une réactivité faible car son électron non apparié est stabilisé par résonance, et se transforme aisément soit en AA soit en acide dehydroascorbique (DHA) (Fig.15). Le radical ascorbyle et le DHA sont faiblement réactifs malgré la perte de leurs électrons.
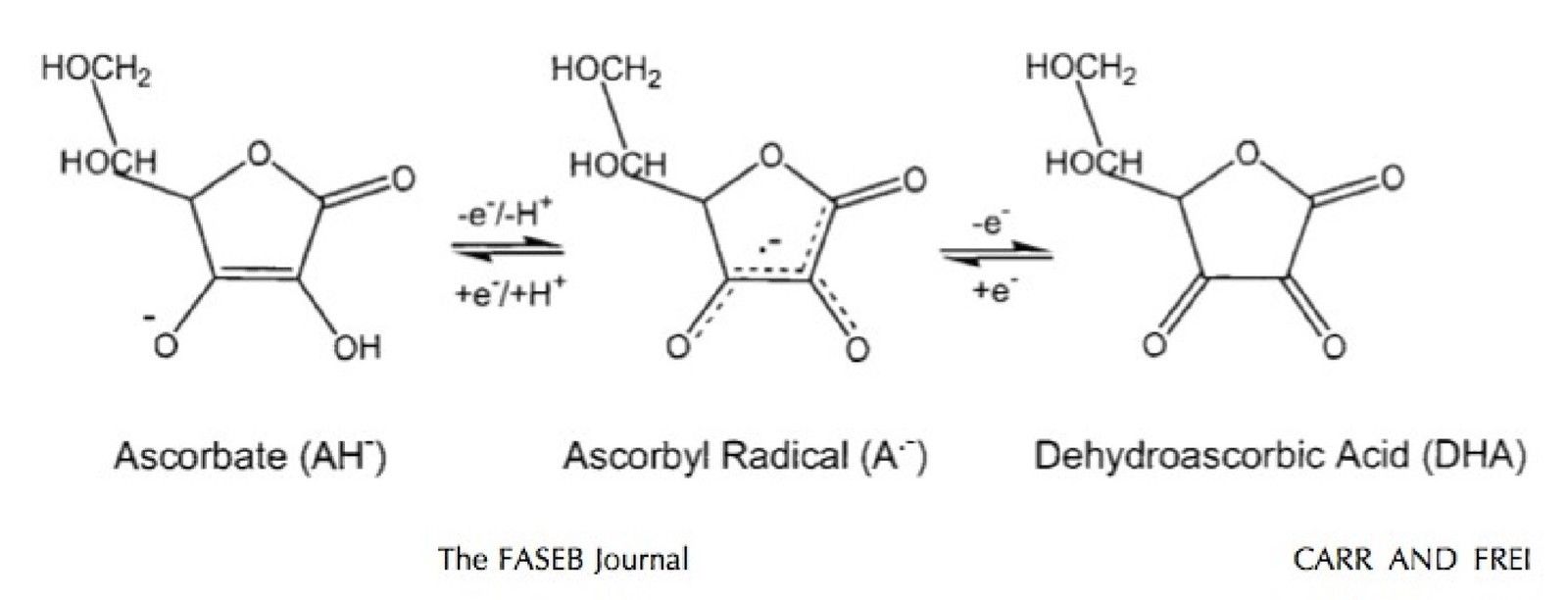
Fig. 15 : Oxydo-réduction de l'AA en deux étapes.
La vitamine C est le co-substrat des enzymes hydroxylases et oxygénases qui participent à la biosynthèse du pro-collagène, de la carnitine et des neurotransmetteurs.
En résumé :
1- Le radical ascorbyl possède une réactivité faible car son électron non apparié est stabilisé par résonance, et se transforme rapidement soit en AA soit en DHA (qui sera réduit dans les cellules). De plus le radical ascorbyle peut être réduit directement au niveau membranaire.
2- À la différence des études in vitro, chez l’homme l’AA n’augmente pas l’oxydation de l’ADN, des lipides et des protéines, même en présence de fer, de cuivre et de peroxyde d’hydrogène. Au contraire, l’AA prévient la peroxydation lipidique causée par les ions métalliques, et les dommages sur l'ADN et les protéines.
La vitamine C protège les lipides, les protéines et l'ADN des dommages oxydatifs, sachant qu'un stress oxydant est présent dans la plupart des maladies.

/image%2F2517154%2F20190326%2Fob_e5cdc3_adn-image.jpg)